動物衛生研究部門
V.蛍光法による生体材料中 セレンの測定
測定原理
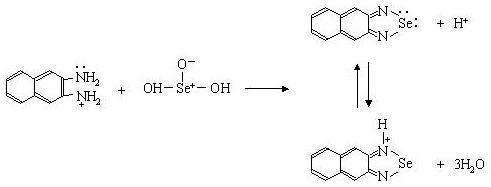
この方法では、まず試料を湿式灰化した後、塩酸酸性下で蛍光試薬2,3-diaminonaphthlene(DAN)と反応させてpiazselenol 体を誘導する。これをシクロヘキサンで抽出して、その蛍光強度を測定するものである。サンプルとしては全血、血漿(清)、尿、乳汁、組織などあらゆる生体組織を用いることができる。
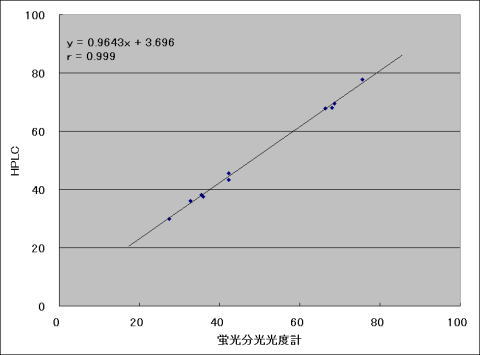
原法では、蛍光分光光度計を使用して蛍光強度を測定しているが、全く同じ処理をしたサンプルについて、HPLCと蛍光検出器を用いても測定可能である。
文献
- R.F.Bayfield, L.F.Romalis. pH control in the fluorometric assay for selenium wiht 2,3 diaminonaphthalene. Anal. Chem. 144:569-576, 1985
目次
1.準備物
(1)器具
- 試験管(共栓付き)
- ヒートブロック(200 °Cまで可能なもの)
- 蛍光光度計 あるいは HPLC
- 恒温槽
(2)試薬(試薬はDAN以外は全て特級、水は通常の蒸留水で良い)
- セレン標準液 (1,000 μg/ml 和光純薬)
- 硝酸
- 過塩素酸 (70%)
- 塩酸
- アンモニア水
- EDTA acid form (EDTA-2Na、-4Naとは異なるので注意)
- 塩酸ヒドロキシルアミン
- メチルオレンジ
- シクロヘキサン
- 2,3-ジアミノナフタレン(DAN) (Dojin)
2.試薬調製法
(1)測定に用いる酸塩基類溶液
- 0.1N 硝酸 (Se標準液の希釈用)
- 5N アンモニア (マスキング試薬の調製用)
- 5N 塩酸 (Se還元反応用)
- 7.5N アンモニア (pH調整用)
- 1N 塩酸 (pH調整用)
(2)Se標準液(150、100、50、0 ng/ml )
市販のSe標準液(1,000 μg/ml)を0.1N 硝酸で希釈して調整する。
0 ng/ml溶液は、0.1N 硝酸溶液をそのまま用いる。
(3)分解試薬
硝酸:過塩素酸=2:1(v/v)
(4)マスキング試薬
- A液:EDTA7.6 gを取り、D.W80 mlを加える。次に5N アンモニア水を、EDTAが溶けるまで加える。
- B液:塩酸ヒドロキシルアミン24 gに水500 mlを加えて溶解。
- C液:メチルオレンジ0.05%水溶液40ml
- A,B,C液を混合し、D.Wで1,000 mlとする。
(5)DAN試薬 使用直前に調製し、遮光する
2,3ジアミノナフタレン0.1%溶液(0.1N 塩酸で溶解)
3.操作手順
(1)共栓付試験管に試料および標準液を入れ、これに分解試薬3 mlを加える。
サンプル量は、血清、全血の場合、250 μl、 乾燥組織粉末では25~50 mg
標準溶液は250 μl
(2)ヒートブロックで加熱分解(湿式灰化)
130°Cでしばらく加熱した後、1時間程度かけてで、190°Cまで温度を徐々に上げていく(写真左)。
約3~4時間後、分解を終了
灰化は徐々に温度を上げつつ、硝酸が適度に還流しながら少しずつ蒸発するようにし、最後に過塩素酸だけ残るようにする(1 ml以下)
残液量約1 ml、澄んだ黄色~無色透明を呈する(写真右:左側は灰化前、右側は灰化後)
130~140°Cで突沸しやすいためゆっくり温度をあげる。
ドラフト内で行なう時、190°Cに設定しても十分温度があがらない場合がある。
このような時は、ヒートブロックと試験管の横をアルミホイルでおおう(写真中)。
温度不足だと灰化が不十分となり、数値上昇の原因となる。
液が全て蒸発しないように注意。
セレンが蒸発する可能性があるので190°C以上には加熱しない



(3)試験管を冷却(室温程度)
(4) 5N 塩酸を0.4 ml加えて130°C~150°Cで15分反応。
この反応で6価のセレンは4価に還元される。
(5)試験管を冷却(室温程度)
(6)マスキング試薬2 mlを加える。
マスキング試薬は共存する他の金属イオンをキレート化しDANとSeの反応への妨害を防ぐために加える。
(7) 7.5N アンモニア水を溶液が黄色になるまで加える。
次に、1N 塩酸を溶液がピンクになるまで加える
ここでpH3となる。
 1: マスキング試薬 2 mlを加える
1: マスキング試薬 2 mlを加える
2: 7.5N アンモニア水を加え黄色に変化
3: 1N 塩酸を加え溶液がピンクに変化
DAN試薬とSeの反応のためにはpHを正確に調整する必要がある。したがってこの操作は、パスツールピペットを用いて慎重に行うこと。色の変わったところで止める。 入れすぎたら、再度アンモニア水を加えてやり直す。
(8)DWを加えて全量を 9mlにそろえる
(9)DAN試薬を作製し、各1ml加えてよく攪拌する
ここでpH1.8となっている。
DAN試薬は使用直前に調整する。
これ以後の操作は暗所で行うか、試験管立て全体をアルミホイルで覆って行なう。
(10)恒温槽で50°C30分反応
(11)試験管を冷却(室温程度)
(12)シクロヘキサンを5ml加える
(13)振とう機で攪拌 (50strokes/min、30分)
(14)遠心分離(3,000rpm, 5min)
(15)上層のシクロヘキサン層を分取
(16)測定
蛍光分光光度計
- 励起波長380nm、蛍光波長525nm
- 蛍光分光光度計の一般的使用法
HPLC
- カラム シリカゲルカラム
- 溶離液 シクロヘキサン:酢酸エチル=75:25
- 流速 1.5ml/min
- カラム温度 40°C
- 試料注入量 200μl
- 検出 蛍光検出器(励起波長380nm、蛍光波長525nm)
4.補足説明
(1)測定波長
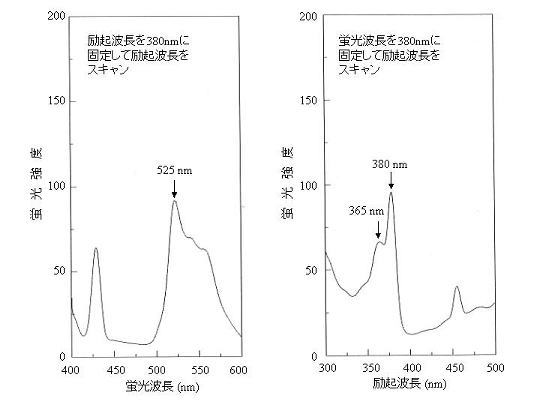
Bayfield & Romalis 1985 では、蛍光の測定波長を励起波長364nm、蛍光波長525nmとしている。文献によっては励起波長が380nmのものもある。
DAN-Se溶液について励起波長および蛍光波長のスキャンを行なった結果を下の図に示す。図の通り、励起波長には365nmと380nmのふたつの極大があるが、どちらの波長を使っても定量性がある。ここでは蛍光強度が高い380nmを使用することとした。
(2)蛍光分光光度計とHPLCとの比較