動物衛生研究部門
ヨーネ病遺伝子検査 Q&A
検体処理、DNA抽出
Q1:採材当日中に遺伝子検査が行えない時は、糞便を何°Cに保存すれば良いですか?
Q2:糞便は滅菌蒸留水と滅菌生理食塩水のどちらで希釈する方が良いですか?
Q3:糞便を希釈後、混合攪拌するのはどのような方法が推奨されますか?
Q4:ヨーネ菌DNA抽出キットを用いてDNAを抽出・精製する場合、DNAを溶出する時にわずかに洗浄液がスピンカラムに残っていることがありますが、そのまま溶出液を添加しても問題はないでしょうか?
リアルタイムPCR検査共通
Q6:ウラシル-N-グリコシラーゼ(UNG)を添加する目的は何ですか?
Q7:UNG処理によって、キャリーオーバーしたPCR産物は100%分解できますか?
Q8:リアルタイムPCR装置によっては、温度変化を高速に行えるモードがありますが、装置の最速の温度設定条件でPCRを行っても良いですか?
Q9:リアルタイムPCR装置LightCycler 96(ロシュ・ダイアグノスティックス)を使用する場合、反応プログラムの最後にクーリングステップ(37°C、30秒)を追加しても良いですか?
Q10:リアルタイムPCRにおける検体の蛍光増幅曲線が、陽性コントロールの反応と比べ、傾きが緩やかに見えることがありますが(下図青線)、なぜでしょうか?
ヨーネ・ファインドプロ®を用いるリアルタイムPCR検査
Q11:FAMの蛍光強度の上昇を認めましたが、Atto532(VIC/HEX)は非検出でした。判定不能でしょうか?
Q16:試験成立条件は、検量線の相関係数(R)の二乗値(R2)が0.9以上であり、PCR効率は80~120%となっていますが、どのくらいが望ましいのでしょうか。
Q17:1/2ウェルでDNA陽性となり、計算上のDNA量が0.001 pg以上の時、「ヨーネ病患畜」となるのでしょうか?
【ヨーネジーン・KS®を用いるリアルタイムPCR検査】
Q18:判定に係わる注意にマニュアル設定に関する注意事項が記載されていますが、具体的にはどのような場合にマニュアル設定が必要なのでしょうか?
Q19:融解曲線解析における解離温度の許容範囲は何°Cまでですか?解離温度は指示陽性DNA全体の平均を用いるのか、あるいは最低、最高温度を用いるのですか?
Q20:融解曲線解析の方法が機種により様々ですが、統一された術式(温度の上昇スピード等)でなくて良いのですか?
Q21:融解曲線解析において指示陽性DNAの解離温度とほぼ同様な値を示す小さなピークが認められましたが、ピークの形状が指示陽性とは少し異なります(下図)。この結果をDNA陽性と判定するのでしょうか。
ヨーネ・ファインド®を用いるリアルタイムPCR検査
Q22:陽性解離温度の範囲内にピークを認めましたが、陰性解離温度の範囲内にピークがなく、インターナルコントロールは増幅していないと考えられました。判定不能でしょうか?
Q23:融解曲線解析のグラフで陽性解離温度付近に小さなピークを認めましたが、Tm値は表示されませんでした。陰性解離温度の範囲内にピークを認めた場合は、陰性と判定してよいでしょうか?
その他
Q26:ヨーネ病検査マニュアルにあるヨーネ菌DNA抽出効率検定用糞便の入手方法を教えてください。
Q27:ヨーネ病検査マニュアルに載っていないリアルタイムPCR装置を使用しても良いですか?新たに購入する場合、推奨する機種はありますか?
検体処理、DNA抽出 .Answer
Q1:採材当日中に遺伝子検査が行えない時は、糞便を何°Cに保存すれば良いですか?
A1:糞便あるいは糞便懸濁液の状態で、4°Cで2週間保存可能です。2週間以上の場合は-20°Cあるいは-80°Cに凍結保存してください。なお、同じ糞便で培養検査を実施するのであれば、ヨーネ菌の生存率の低下を防ぐため、4°C等には置かずに-80°Cへ保存してください。
Q2:糞便は滅菌蒸留水と滅菌生理食塩水のどちらで希釈する方が良いですか?
A2: 遺伝子検査用としてはどちらでも構いません。同じ糞便懸濁液で培養検査を実施するのであれば、滅菌生理食塩水を推奨します。
Q3:糞便を希釈後、混合攪拌するのはどのような方法が推奨されますか?
A3: 振とう機を用いて30分間、あるいはボルテックスミキサーで30秒以上攪拌してください。山羊、めん羊等の糞便では、あらかじめペレット状の糞便を潰してから攪拌し、均一な懸濁液にしてください。
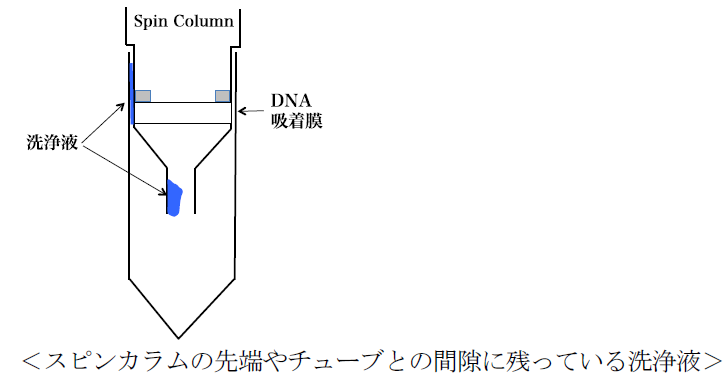
Q4:ヨーネ菌DNA抽出キットを用いてDNAを抽出・精製する場合、DNAを溶出する時にわずかに洗浄液がスピンカラムに残っていることがありますが、そのまま溶出液を添加しても問題はないでしょうか?
A4:洗浄液の除去が不十分だと、スピンカラムの先端やチューブとの間隙に洗浄液が残っている場合があります(下図参照)。このような場合は、コレクションチューブ内の濾液を廃棄してから、再度スピンカラムを遠心してください。エタノールを含む洗浄液が混入すると、ヨーネ菌DNA濃度に影響するとともに、融解温度(Tm値)の低下につながります。スピンカラムに付着した洗浄液を完全に除去してからDNAの溶出操作を行うようにしてください。
Q5:DNA抽出後、直ちにPCRを実施しない時は、どのように保存すれば良いですか?
A5:抽出したDNAは-20°C以下で凍結保存してください。解凍後は、タッピングあるいは短時間のボルテックスにより攪拌し、スピンダウンしてから使用してください。
リアルタイムPCR検査共通 .Answer
Q6: ウラシル-N-グリコシラーゼ(UNG)を添加する目的は何ですか?A6:PCRで増幅された産物には、チミンに替わりウラシル塩基が取り込まれています。仮にPCR産物が混入(=キャリーオーバー)してしまっても、UNG処理によって分解されるため、PCRの鋳型となって増幅されることを防ぐことができます。
Q7:UNG処理によって、キャリーオーバーしたPCR産物は100%分解できますか?
A7:混入量が多い場合は、UNG処理で分解しきれないことがあります。反応終了後のプレート(チューブ)は開けずに廃棄するようにしてください。PCR産物の電気泳動等が必要な場合は、コンタミネーションに十分注意してください。
Q8:リアルタイムPCR装置によっては、温度変化を高速に行えるモードがありますが、装置の最速の温度設定条件でPCRを行っても良いですか?
A8:Fastモードへの対応は確認していません。Standardモードで実施してください。
Q9:リアルタイムPCR装置LightCycler 96(ロシュ・ダイアグノスティックス)を使用する場合、反応プログラムの最後にクーリングステップ(37°C、30秒)を追加しても良いですか?
A9:LightCycler 96では、温度が高いまま終了すると、余熱でキャップがはずれてしまうことがあり、コンタミネーションの原因となる可能性があります。チューブの余熱を取るために、クーリングステップを追加しても結果に影響はないと考えますので、メーカー推奨の設定で実施してください。
Q10:リアルタイムPCRにおける検体の蛍光増幅曲線が、陽性コントロールの反応と比べ、傾きが緩やかに見えることがありますが(下図青線)、なぜでしょうか?
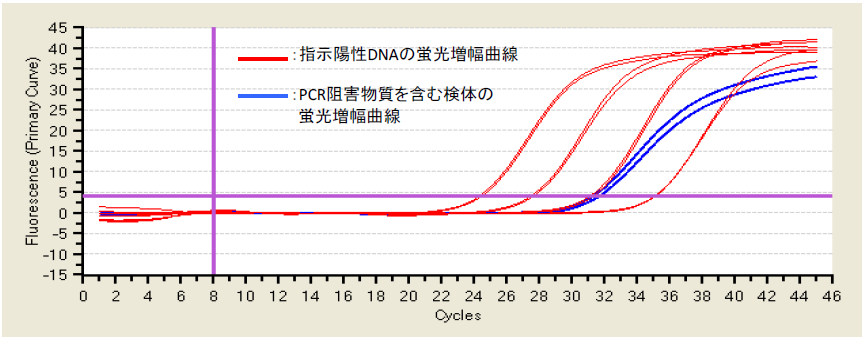
A10:糞便等から調製されたDNAサンプル中にPCR阻害物質が含まれる為にPCR効率が低下し、陽性コントロールの反応に比べてDNAの増幅が遅れる為だと思われます。
ヨーネ・ファインドプロ®を用いるリアルタイムPCR検査 .Answer
Q11:FAMの蛍光強度の上昇を認めましたが、Atto532(VIC/HEX)は非検出でした。判定不能でしょうか?
A11:FAMの蛍光強度が上昇していれば、Atto532の結果にかかわらず陽性と判定されます。ヨーネ・ファインドプロ®では、同じプライマーでヨーネ菌標的遺伝子とインターナルコントロール(IC)の両方を増幅しているため、競合によりICが増幅されないことがあります。陽性と判定されたウェルでは、Atto532の判定を行わないようにしてください。
ヨーネ・ファインドプロ®を用いるリアルタイムPCR検査 .Question
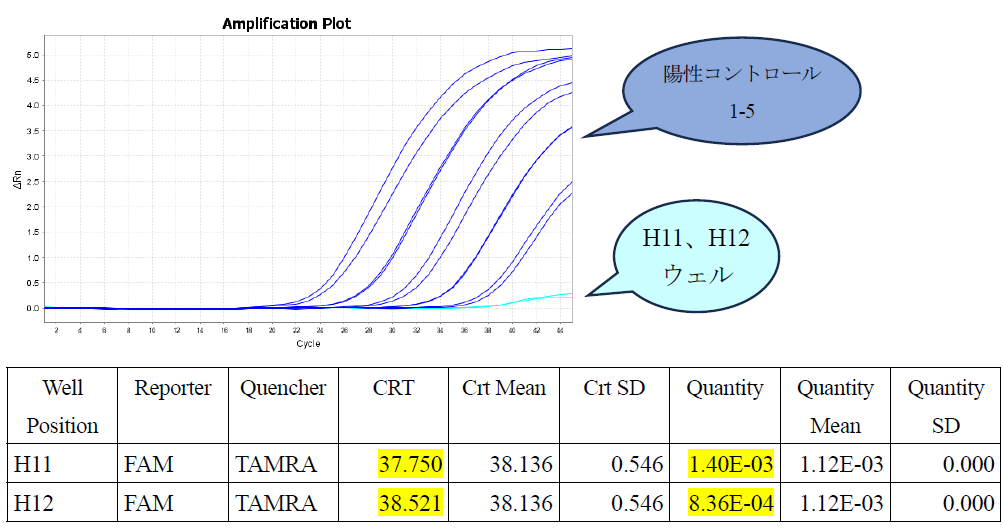
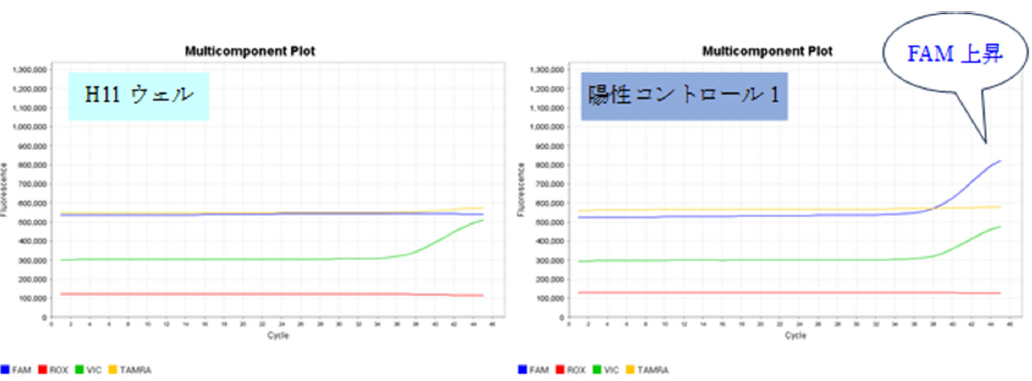
Q12:リアルタイムPCR装置QuantStudio3(サーモフィッシャーサイエンティフィック)において、FAMの蛍光強度がほとんど上昇していないにもかかわらず、CRTが"undetermined(非検出)"ではなく、数値が表示される場合があります(下表H11、H12ウェル)。どのように判定すれば良いでしょうか?
ヨーネ・ファインドプロ®を用いるリアルタイムPCR検査 .Question
Q13:リアルタイムPCR装置QuantStudio3/QuantStudio5(サーモフィッシャーサイエンティフィック)において、FAMの蛍光強度が2穴とも同じように上昇しているにもかかわらず、1穴のCRTが"undetermined(非検出)"になりました(下表A3ウェル)。どのように判定すれば良いでしょうか?
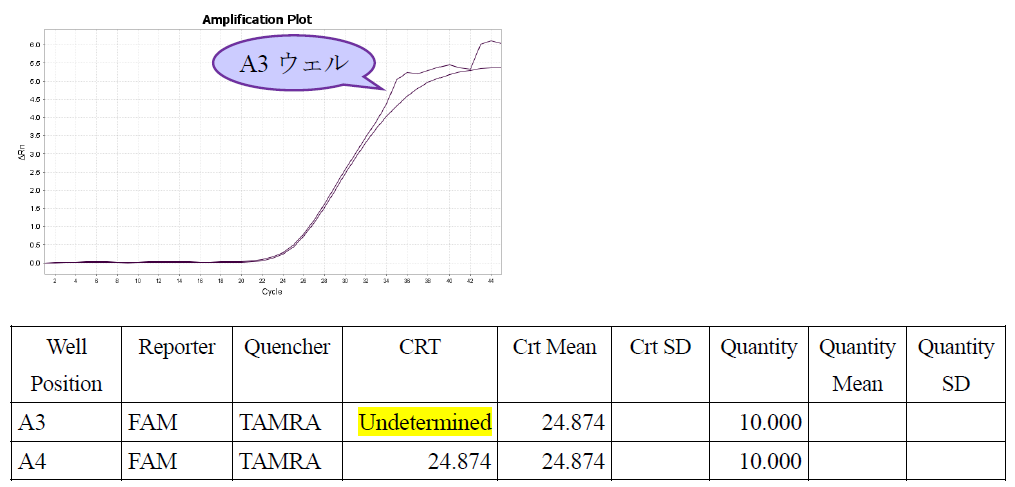
A13:A3ウェルの増幅曲線が反応後半で乱れており、Relative Thresholdモードで解析できなかったと考えられます。解析方法を、装置所定の「Relative Threshold」から「Baseline Threshold」に変更して、再解析してください。その際、スレッショルドラインが非特異的なバックグラウンドの蛍光増幅曲線と交叉しないように注意してください。交叉する場合には、マニュアルモードにより、蛍光強度が指数関数的に増幅している範囲内に設定を変更してください。
ヨーネ・ファインドプロ®を用いるリアルタイムPCR検査 .Question
Q14:リアルタイムPCR装置QuantStudio3/QuantStudio5(サーモフィッシャーサイエンティフィック)において、増幅曲線のグラフ上は、陽性コントロール5(0.001 pg/PCR相当)よりも後にFAMの蛍光強度が上昇しているにもかかわらず、陽性コントロール5よりも低いCRT値が示され、遺伝子量が0.001 pg/PCR以上になりました(下表C7ウェル)。ヨーネ病患畜と診断して良いでしょうか?
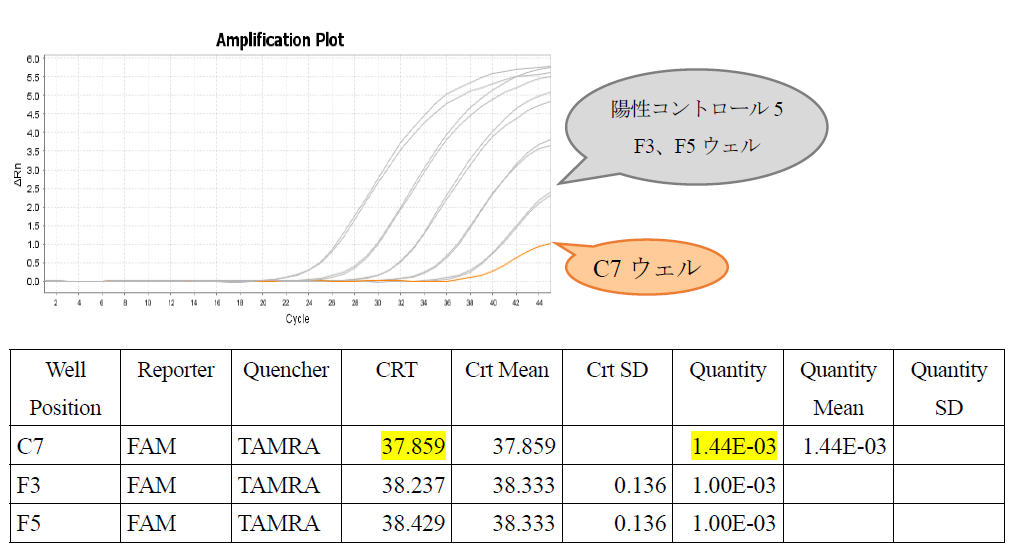
A14:C7ウェルの増幅曲線は立ち上がりが悪く蛍光シグナルが低いため、わずかな蛍光値の変化をとらえてCRTが算出された可能性が考えられます。解析方法を、装置所定の「Relative Threshold」から「Baseline Threshold」に変更して、再解析してください。その際、スレッショルドラインが非特異的なバックグラウンドの蛍光増幅曲線と交叉しないように注意してください。交叉する場合には、マニュアルモードにより、蛍光強度が指数関数的に増幅している範囲内に設定を変更してください。
ヨーネ・ファインドプロ®を用いるリアルタイムPCR検査 .Question
Q15:リアルタイムPCR装置LightCycler 96(ロシュ・ダイアグノスティックス)において、ヨーネ病患畜臓器由来の検体を用いたところ、増幅曲線のグラフ上はFAMの蛍光強度が上昇しているように見えるにもかかわらず、Cq値が算出されず陰性と判定されました(下表E1ウェル)。どのように判定すれば良いでしょうか?
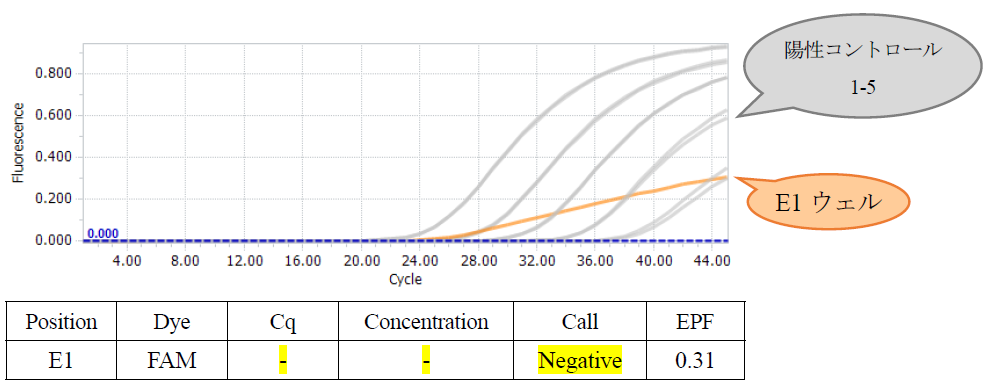
A15:E1ウェルはPCRの増幅効率が悪く、蛍光値の変化量がデフォルト設定で解析可能な範囲に到達しなかったと考えられます。FAMのMinimal EPF(Endpoint Fluorescence:反応終了時の蛍光値)を0.05~0.1に設定して、再解析してください。なお、ICの判定(Atto532)は、所定のとおりMinimal EPFを0.05に設定して行ってください。
ヨーネ・ファインドプロ®を用いるリアルタイムPCR検査 .Question
Q16:試験成立条件は、検量線の相関係数(R)の二乗値(R2)が0.9以上であり、PCR効率は80~120%となっていますが、どのくらいが望ましいのでしょうか。
A16:できるだけ正確にDNA量を測定するために、R2値は0.98以上、PCR効率は90~110%を目指してください。
ヨーネ・ファインドプロ®を用いるリアルタイムPCR検査 .Question
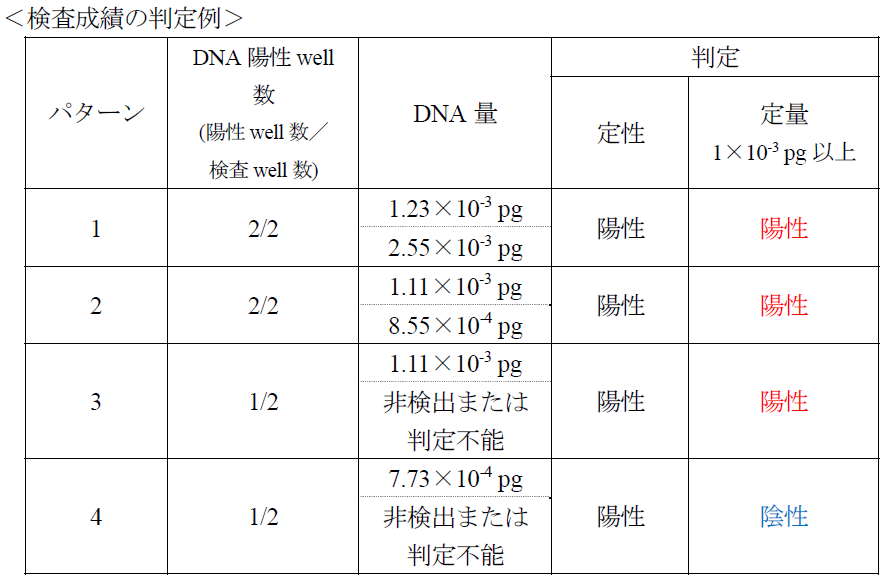
Q17:1/2ウェルでDNA陽性となり、計算上のDNA量が0.001 pg以上の時、「ヨーネ病患畜」となるのでしょうか?
A17:ヨーネ菌DNA量が0.001 pg/PCR (2.5 μL) 以上の場合は、ヨーネ菌分離成績と高い一致率を示すので、定量陽性と判定します。下表にヨーネ・ファインドプロ®における成績例と判定を示します。なお、定量判定で陽性となった家畜が「ヨーネ病患畜」であるかどうかの診断は、家畜伝染病予防法施行規則別表第1に従ってください。
【ヨーネジーン・KS®を用いるリアルタイムPCR検査 .Answer】
Q18:判定に係わる注意にマニュアル設定に関する注意事項が記載されていますが、具体的にはどのような場合にマニュアル設定が必要なのでしょうか?
A18:自動解析モードで引かれたスレッショルドラインが非特異的なバックグラウンドの蛍光増幅曲線と交差する場合、スレッショルドラインの設定位置をマニュアルモードにより,交差しないように設定を変更します(下図参照)。その際,新たに設定するスレッショルドラインの位置は蛍光強度が指数関数的に増幅している範囲内で試験成立条件を満たすように設定します。
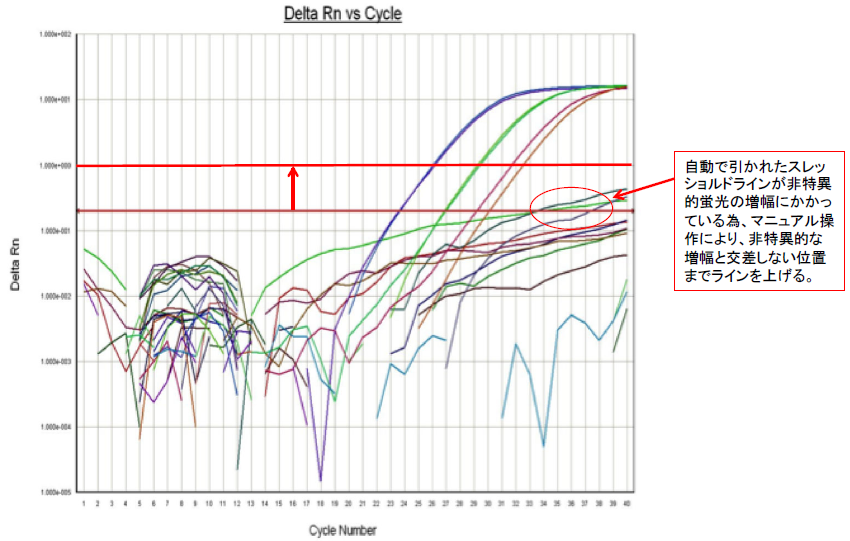
ヨーネジーン・KS®を用いるリアルタイムPCR検査 .Question
Q19:融解曲線解析における解離温度の許容範囲は何°Cまでですか?解離温度は指示陽性DNA全体の平均を用いるのか、あるいは最低、最高温度を用いるのですか?
A19: 指示陽性DNAの解離温度は得られたTm値の平均値を用います。また、各糞便検体の解離温度の許容範囲はその平均値の±1.5°Cです。例えば、指示陽性DNAの解離温度が87.5°Cの場合、検体の解離温度が87.5±1.5°Cの範囲であれば陽性と判定します。
ヨーネジーン・KS®を用いるリアルタイムPCR検査 .Question
Q20:融解曲線解析の方法が機種により様々ですが、統一された術式(温度の上昇スピード等)でなくて良いのですか?
A20: 装置のデフォルト設定での解析を優先して下さい。また、機種によってはROX補正を行いますが、上手く融解曲線解析が行えない時は、ROX補正を外して実施してみて下さい。
ヨーネジーン・KS®を用いるリアルタイムPCR検査 .Question
Q21:融解曲線解析において指示陽性DNAの解離温度とほぼ同様な値を示す小さなピークが認められましたが、ピークの形状が指示陽性とは少し異なります(下図)。この結果をDNA陽性と判定するのでしょうか。
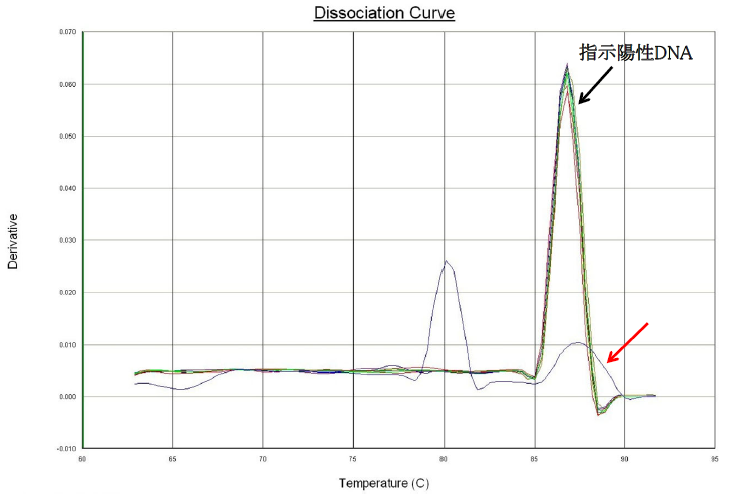
A21: 赤い矢印で示した88°C付近の緩やかなピークは、何らかの原因でPCR反応液の蛍光が非特異的に低下した為に、融解曲線解析において小さなピークを形成したと思われます。融解曲線解析における生データ(Raw data、下図)を見ると、指示陽性DNA由来の増幅産物は86°C付近から蛍光強度が急速に低下しますが、当該サンプルの蛍光強度の低下速度は指示陽性と比べて明らかに遅くなっています。この為、一次微分のグラフ上では緩やかなピークとして表示されます。このような指示陽性DNA由来増幅産物と明らかに異なる融解曲線解析像を示したサンプルは陰性と判定します。
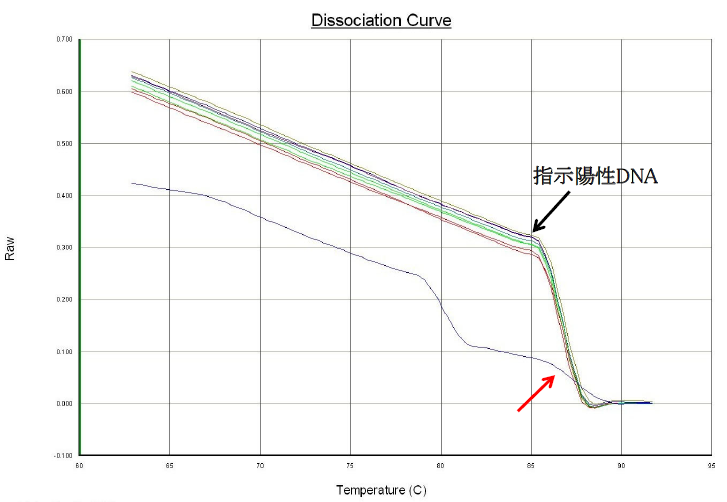
ヨーネジーン・KS®を用いるリアルタイムPCR検査 .Question
ヨーネ・ファインド®を用いるリアルタイムPCR検査 .Answer
Q22:陽性解離温度の範囲内にピークを認めましたが、陰性解離温度の範囲内にピークがなく、インターナルコントロールは増幅していないと考えられました。判定不能でしょうか?
A22: 陽性解離温度の範囲内にピークを認めた場合は、陰性解離温度のピークの有無にかかわらず陽性と判定されます。ヨーネ・ファインド®では、同じプライマーでヨーネ菌標的遺伝子とインターナルコントロール(IC)の両方を増幅しているため、競合によりICが増幅されないことがあります。
ヨーネ・ファインド®を用いるリアルタイムPCR検査 .Question
Q23:融解曲線解析のグラフで陽性解離温度付近に小さなピークを認めましたが、Tm値は表示されませんでした。陰性解離温度の範囲内にピークを認めた場合は、陰性と判定してよいでしょうか?
A23: ピークの有無の判定は、基本的に装置の自動解析で行ってください。ただし、家畜防疫員が陰性を否定できないと判断する場合は、必要に応じて再検査を実施してください。
ヨーネ・ファインド®を用いるリアルタイムPCR検査 .Question
Q24:リアルタイムPCR装置LightCycler 96(ロシュ・ダイアグノスティックス)において、陽性解離温度及び陰性解離温度が、所定の範囲内(陽性91.5±2°C、陰性85.5±2°C)ではあるものの高めに表示されることがあるようです。判定の際に気をつけることはありますか?
A24: まず、装置の点検・整備状況を確認してください。その上で、陽性/陰性コントロールにおける融解温度が基準値よりも大きくずれている場合は、検体の判定においては、その値を参考に±2°Cの範囲に再設定してください。
ヨーネ・ファインド®を用いるリアルタイムPCR検査 .Question
Q25:ヨーネ・ファインド®を用いるリアルタイムPCR検査では、なぜDNA量の定量ができないのでしょうか?
A25: ヨーネ・ファインド®では、インターカレーション法により遺伝子の増幅を検出しています。そのため、ヨーネ菌遺伝子とインターナルコントロール(IC)の増幅を区別して、それぞれの鋳型量を測定することはできません。正確なヨーネ菌DNA量の定量はできませんが、Cq値からある程度推測することは可能です。
その他 .Answer
Q26:ヨーネ病検査マニュアルにあるヨーネ菌DNA抽出効率検定用糞便の入手方法を教えてください。
A26: (国研)農研機構動物衛生研究部門に問い合わせてください。研究用試料提供契約を締結後、公的機関の場合は無償で提供されます。
Q27:ヨーネ病検査マニュアルに載っていないリアルタイムPCR装置を使用しても良いですか?新たに購入する場合、推奨する機種はありますか?
A27: ヨーネ病の遺伝子検査に使用可能であることが確認されていない機種を使用する場合は、各キットに付属する陽性/陰性コントロールを用いて動作確認を行ってください。その際、ヨーネジーン・KS®及びヨーネ・ファインド®においては、当該機種の陽性/陰性の解離温度を測定してください。推奨する機種は特にありません。

