村上洋介
農林水産省家畜衛生試験場ウイルス病研究部病原ウイルス研究室長
Foot-and-Mouth Disease Virus and the Disease Nature by the Virus
Yosuke MURAKAMI
National Institute of Animal Health, Tsukuba, Ibaraki 305-0856, Japan
初出:山口獣医学雑誌. 24, p.1-26(1997) / 日獣会誌. 53, p.257-277(2000)に転載
目次
Foot-and-mouth disease (FMD) affects all cloven-hoofed animals and is considered the most infectious of all animal diseases. It is endemic in many countries of the world, including Africa, Asia and parts of South America, where its importance relates to not only to the reduced productivity of livestock, but to the restrictions placed on the international trade of animals and their products. The causative agent, FMD virus which classified genus Aphthovirus of the Family Picornaviridae, has seven serotypes, designated as types O, A, C, SAT(South African teritorries) 1, SAT2, SAT3 and Asia1. The infection with any serotypes does not confer immunity against other serotypes. Antigenic variation is also observed even in the same serotypes, which had been designated by subtypes until the late 1980's. In addition, the infection has many difficult aspects to be controlled when compared with the other animal diseases. In March 1997, a large scale epidemic of FMD occurred in Republic of China, Taiwan. The outbreaks forced to have a large socio-economic impact to the country which came from loss of over four million pigs and lost international pork markets, specially for Japan. Japan, free from FMD nearly for a century, is a major country to import animals and animal products of the world, while a considerable population of livestock has been maintained inside of the country. Besides, the trade in animals and animal products has greatly expanded under the World Trade Organization rules. These situation forces to have a continuous threat from the invasion of FMD to Japanese animal husbandry than before.
Therefore, it is essential to have the correct comprehension on the disease nature of FMD for the prevention from the invasion. This article reviews the present situation of FMD in the world, virology, epidemiology, diagnosis, immunoprophylaxis and disease control measurements of the disease.
口蹄疫はピコルナウイルス科アフトウイルス属に分類される口蹄疫ウイルスの感染による急性熱性伝染病で、伝染力が強く、牛、水牛、豚、めん羊、山羊などの家畜をはじめ野生動物を含むほとんどの偶蹄類動物が感染する。病名は発病動物の口、蹄及び乳房周辺の皮膚や粘膜に水疱が形成されることに由来する。
口蹄疫による致死率は、幼畜では高率で、時に50%を越えることがあるが、成畜では一般に低く数%程度である。しかし、ウイルスの伝染力が通常のウイルスに類を見ないほど激しく、加えて発病後に生じる発育障害、運動障害及び泌乳障害などによって家畜は産業動物としての価値を失うために、直接的な経済被害はきわめて大きいものとなる。さらに一度発生すると、国あるいは地域ごとに厳しい生畜と畜産物の移動制限が課せられるため、畜産物の国際流通にも影響が大きく、間接的に生じる社会経済的な被害は甚大なものとなる。このため、国際獣疫事務局(OIE)は、本病を最も重要な家畜の伝染病(リストA疾病)に位置付けている41,87)。わが国でも本病は家畜の法定伝染病に指定され、その防疫は「海外悪性伝染病防疫要領」(農林水産省畜産局長通達、昭和50年9月16日付、一部改正昭和51年7月5日)に基づいて実施することになっている。
口蹄疫ウイルスには、相互にワクチンが全く効かないO、A、C、Asia1、SAT1、SAT2及びSAT3の7種類のタイプ(血清型)がある。さらに同一タイプ内にも、部分的にしかワクチン効果が期待できない、従来はサブタイプ(亜型)と呼ばれていた多数の免疫型が存在する。しかも、ウイルス抗原は変異を起こしやすく、ワクチンのみでは本病の根絶は困難である。さらに、反芻獣が免疫を獲得した後長期間持続感染するキャリア化する問題もあって、現在ほとんどの先進国は、本病に対して移動制限と殺処分方式により防疫を図り常在化を防ぐことを防疫の基本方針にしている。
本病の発生に関する記載は古く、すでに16世紀半ばにはイタリアでの発生が報告されている。その後、原因がウイルスであることが判明した19世紀末までに、ヨーロッパ、アジア、アフリカおよび南北アメリカなど、ほぼ世界的な発生がみられている。現在もヨーロッパの一部で散発的な、また南アメリカ、アジア及びアフリカ諸国の広範な地域で常在的な発生がある。これまでに長年発生のない国は、日本、韓国、オーストラリア、ニュージーランド、アメリカ、カナダ、スウェーデン、ノルウェー及びフィンランドのほか数カ国程度である。後述するように、台湾では過去70年間近く発生がなかったが、1997年に大規模な発生があった。初発例から4ヶ月の間の累積発生農場数は6,147農場で、そのうち発症頭数と蔓延防止のために殺処分された頭数はそれぞれ1,011,674頭及び3,850,746頭にのぼり、記録的な大規模な流行になった。一方、日本では今世紀初頭に発生があったが、島国という地理的な条件に恵まれて、幸いにその後約1世紀近くの間は発生を経験していない。しかしながら、近年近隣国に発生が続き、畜産物輸入量も年々増加していることから、わが国でも口蹄疫など海外伝染病の発生動向に無関心ではいられない情勢にある。
口蹄疫ウイルスは、動物ウイルスの中でも最も深く研究が進められたウイルスのひとつである。口蹄疫ウイルスの分子生物学的解説は他の総説に譲ることとし100)、本総説では、口蹄疫ウイルスの生物学的性状に重点を置き、口蹄疫の病性、診断、防疫についての現状を概説する。

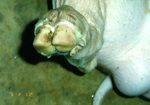
豚の鼻端の水疱、水疱上皮が剥離した状態(農林水産省動物検疫所、衛藤真理子原図、同右)
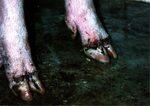
 牛の舌と上顎歯齦部の水疱、水疱上皮は剥離し、びらんを形成する。
牛の舌と上顎歯齦部の水疱、水疱上皮は剥離し、びらんを形成する。
1. 口蹄疫ウイルスの性状
1) 分類と形態
口蹄疫ウイルスはエンベロープを持たない直径21~25nmの球形ウイルスで、ピコルナウイルス科(Family Picornaviridae)のアフトウイルス属(Genus Aphthovirus)に分類される68,100)。ウイルス感染細胞の培養上清中には、沈降係数146Sの完全粒子、75Sの中空粒子、12Sサブユニット、ウイルス核酸及びVIA(virus-infection-associated)抗原などの非構造蛋白質が検出される68,100)。146S完全粒子は、ウイルス核酸1分子を核にそれぞれ60分子の4種類のキャプシド蛋白質(VP1、VP2、VP3、VP4)が規則的に集合した構造を持つ。これら4種類のキャプシド蛋白質を持つ最小構成単位をプロトマーと呼ぶ。146S完全粒子は、免疫原として重要で、不活化ワクチンにおいても、その含有量の多少はワクチンの有効性を左右する。75S中空粒子は、146S完全粒子と核酸を持たない点で異なる。12Sサブユニットは、VP1、VP2及びVP3の5量体である。VIA抗原は非構造蛋白質P3から解裂した3D蛋白質で、分子量約57×103ダルトンのRNAポリメラーゼである68,100)。
2) 温度とpH感受性
口蹄疫ウイルスは、一般的に低温条件ではpH7.0~9.0の中性領域では安定であるが、完全粒子と中空粒子は加熱処理やこのpH域外では最終的に12Sサブユニットに分解し、免疫原性と感染性を失う。このウイルスは、pH4では15秒間で、pH6では2分間で不活化されるが、pH7では数週間生残する。pH7.5で加熱すると、61°Cでは30秒間で、また55°Cでは2分間で不活化されるが、4°Cでは18週間生残する43)。しかし、pHの変動や加熱に対する抵抗性はウイルスのタイプや株によって異なっている。例えば、pHの変動に対しては、Cタイプ(Noville)はAやOタイプのウイルス株に比較して影響を受けやすい。また、加熱に対しては、AとAsia1タイプが最も抵抗性を示し、次いでOとCタイプ、及びSATタイプの順に抵抗性は減弱する30)。なお、口蹄疫ウイルスはエーテルやクロロホルムなどの有機溶媒には抵抗性を示す。口蹄疫が発生したときの消毒薬には、このウイルスのpH易感受性から、安価で大量に調達できる酸や塩基性の薬剤が推奨され、酢酸やクエン酸あるいは水酸化ナトリウムや炭酸ナトリウムなどが使用されている103,115)。
3) 遺伝子と蛋白質
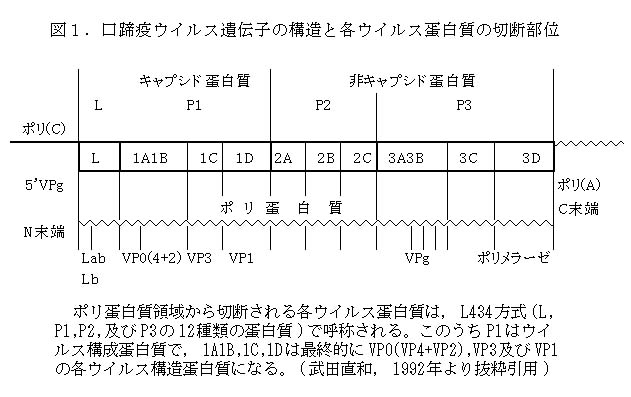
ウイルス核酸は約8,500塩基(分子量2.9x106ダルトン)の感染性を有する陽極性の単鎖RNAで、その基本構造は5'VPg(virion protein genome-linked)-5'非翻訳領域-ポリ蛋白質領域-3'非翻訳領域-ポリ(A)3'となる(図1)。5'非翻訳領域は1,200塩基で、他のピコルナウイルス科のウイルスに比較して長く、しかもポリ(C)配列が存在する。ポリ(C)配列の長さは分離株ごとに一定しており、ウイルス株の同定に有用である。ウイルスRNAには1個の巨大な読みとり枠(open reading frame)が存在し、感染細胞の翻訳機構を利用し、1本のポリ蛋白質が合成される。ついで、ポリ蛋白質はウイルス遺伝子にコードされる蛋白質分解酵素によって段階的に自から切断され、機能を持ったウイルス特異蛋白質となる100)。ポリ蛋白質の構成はピコルナウイルスの統一命名法であるL434方式で示される100,112)。すなわち、Lはリーダー蛋白質に、キャプシド蛋白質のP1、非構造蛋白質のP2及びP3は、最終的にそれぞれ4、3及び4種類の蛋白質に解裂区分されることによる。各ウイルス蛋白質はN末端から順にA、B、C及びDと大文字アルファベットで呼ばれる(図1)。キャプシド蛋白質P1の最終産物1Aと1B(前駆体VP0を経て解裂)、1C及び1Dは、それぞれVP4とVP2、VP3及びVP1に相当する。VP1、VP2及びVP3の分子量は23.3~24.7x103ダルトンとほぼ同じであるのに対し、VP4の分子量は8.5x103ダルトンと小さい。一方、非構造蛋白質のP2及びP3は、最終的にそれぞれ2A、2Bと2C及び3A、3B、3C(3ABC前駆体を経る)と3Dの非構造蛋白に解裂する。これらの蛋白質はウイルス増殖に関与し、3CはLとともにプロテアーゼ活性を持つこと、2Aは機能は明らかではないが他のピコルナウイルスよりサイズが小さく、2BにはB細胞抗原決定基が存在すること、3DはVIA抗原でRNA依存RNAポリメラーゼであることなどが判明している。
4) 抗原性状
口蹄疫ウイルスの感染と免疫に関与する主要な抗原決定基はVP1分子上にある。このことは、感染性ウイルス粒子のトリプシン処理で感受性細胞への吸着や感染性が低下し、SDS-PAGEでウイルス蛋白を調べるとVP1のみがトリプシンのため2つの成分に分裂するが他のVPは影響を受けていないこと、単離したVP1のみが実験動物で中和抗体の産生と感染防御効果を持つことからも明らかである7,68)。さらに、VP1分子上でβ鎖G-Hループに存在するアミノ酸配列141~160番目に主要抗原決定基が、また同200~213番目にも抗原決定基が存在する30,100)。また、これら抗原決定基の145~147番目と203~213番目に存在するArg-Gly-Asp配列(RGD配列)は、宿主細胞のレセプターとの結合に関係している79)。
口蹄疫ウイルスの特徴のひとつは抗原性状に多様性が認められることで、多数のタイプとサブタイプが存在する。口蹄疫ウイルスのタイプとサブタイプは、宿主における感染防御能が相互にまったく欠如する(タイプ)か、あるいは感染防御能が部分的なもの(サブタイプ)か、というワクチンの有効性に関係する現実的な問題から生じている68)。146S完全粒子と75S中空粒子はいずれもタイプ特異的な抗原性状を示すが、12SサブユニットとVIA抗原にタイプ特異性はなく、タイプ間で交差反応が認められる。とくに、146S完全粒子は感染防御能を誘導する口蹄疫ワクチンの主要な免疫源である31)。また、合成ペプチドを用いた研究によると、タイプ特異性はVP1分子上のアミノ酸配列141~158番目の抗原決定基が重要とされている30)。前述したように、口蹄疫ウイルスのタイプには、O、A、C、SAT1、SAT2、SAT3及びAsia1の7種類があるが、同一タイプであっても株間には著しい抗原性状の多様性が認められ、1977年までに合計66種類のサブタイプが確認されている(表1)。なお、後述する理由によって1989年以降は野外株のサブタイプ分類は実施されていない。
口蹄疫ウイルスにみられる著しい抗原の多様性は、宿主の免疫圧力よる選択的抗原変異に起因すると考えられている。口蹄疫ウイルスは8,500塩基からなるRNAウイルスであるので、10,000回の複製に1回発生するというRNAウイルス核酸の推定塩基置換頻度から換算すると、1回のウイルス感染でおおよそ1個の塩基の置換が生じることになる。しかし、モノクローナル抗体で抗原解析した成績によると、口蹄疫ウイルスには4種類の重複しない抗原決定基が存在し、その内1種類でも中和抗体が結合すると中和される。このため、宿主の免疫圧力を回避するための抗原変異は4種類の抗原決定基のすべてに変異が起きる必要があることになる66)。このことから、口蹄疫ウイルスの感染防御に影響する抗原変異の頻度そのものは、上記の推定値よりは低いものと推測されている61)。
5) 培養
口蹄疫ウイルスの培養には、牛、豚、めん羊、山羊など偶蹄類家畜の腎臓や甲状腺由来の初代培養細胞と種々の株化細胞が用いられる。初代培養細胞も継代を進めると感受性が低下する。株化細胞では、豚腎由来のIBRS2細胞、ハムスター腎由来のBHK21細胞、牛腎由来のMDBK細胞などが感受性が高い62)。培養細胞の感受性はウイルス株やその継代歴によっても異なっている。ウイルス分離には子牛甲状腺の初代培養細胞が好んで使用されている107)。しかし、近年特定宿主に親和性が高いウイルス株が出現するようになって、こうしたウイルス株の分離や増殖にはその宿主動物に由来する培養細胞を用いる必要も生じてきている42)。豚に親和性が高かった1997年の台湾株は牛甲状腺初代細胞より豚腎由来のIBRS2細胞で良く増殖し、その差は感染価で102.4TCID50/mlであったという42)。なお、2~7日齢の哺乳マウスもウイルス分離に用いることができるが、ウイルス分離には時間を要する57)。
2. 疫学
1) 最近の発生
1992~1996年における口蹄疫ウイルスの流行地域を表1に示す。
表1. 口蹄疫ウイルスのタイプとその地理的分布1)
| タイプ | サブタイプ数2) | 地理的分布 |
|---|---|---|
| O | 12 | ヨーロッパ、中東、アフリカ、アジア及び南アメリカ |
| A | 32 | ヨーロッパ、中東、アフリカ、アジア及び南アメリカ |
| C | 5 | 南アメリカ、アフリカ及びアジアの一部 |
| SAT1 | 7 | アフリカ |
| SAT2 | 3 | アフリカ |
| SAT3 | 4 | アフリカ |
| Asia1 | 3 | 中東及びアジア |
1) 国際獣疫事務局年報(O.I.E. Bulletin)より、1992~1996年
2) 現在はサブタイプの分類は実施されていない
この間の各タイプの発生件数は、Oが最も多く全体の約半数を占め(49%)、A(25%)、Asia1(10%)、C(6.5%)、SAT2(5.8%)、SAT1、SAT3(1.7%)の順となる62)。従来、O、AとCタイプはヨーロッパ型、SAT1~3タイプはアフリカ型、Asia1タイプはアジア型と通称されてきたように、各タイプの発生には現在も地域的な特徴がある。また、AやOタイプでは、従来のサブタイプでみると固有の地域分布がみられる。各地域における最近の発生概要は以下の通りである62)。ヨーロッパでは欧州連合の発足にともなって、1992年1月から域内のワクチン接種を全面的に中止している。その後、1993~1995年の間にブルガリア、イタリア、ギリシャ、ロシアなどにOタイプを中心に散発的な発生があった。ヨーロッパにおける最近のOタイプには、1995年のロシアのものを除いて、株間に近縁関係が認められている。ロシアにはAタイプの発生もみられている。中東とアジアではO、A及びAsia1タイプの流行がみられるほか、フィリピンにはCタイプの発生がある。また、近年フィリピンや香港で分離されているOタイプは、1995年のロシア、1997年の台湾とベトナムで分離されたOタイプの流行株は遺伝学的に近縁で、いずれも豚に親和性が高いという特徴がある。しかし、東南アジアでは同じOタイプでも、従来から流行しているものと、最近流行地域が拡大する様相がみられる台湾の流行株と同じものが混在している地域もあって、東南アジアの口蹄疫撲滅計画の推進上問題になっている。アフリカではAsia1を除くすべてのタイプの発生があるが、南アフリカ、ボツワナ、モロッコなど最近では発生がみられなくなった国も少なくない。しかし、アフリカでは野生動物を含めた発生の実態はよく分かっていない。南アメリカではO、AとCタイプによる発生がある。ウルグアイとチリがOIEにより清浄国に承認されたほか、アルゼンチン、パラグアイ、ブラジル南部では1995年以降ほとんど発生がない状態が続いている。これらの地域は畜産業の潜在能力が高く、口蹄疫の撲滅によって将来畜産物の国際流通に大きな影響を及ぼす可能性がある6)。また、Aタイプについては、1996年~1997年にかけてイラン、タイ、マレーシア、西アフリカ及びエリトリアにおいて、従来のものに比較して、抗原並びに遺伝学的性状が著しく異なるAタイプの出現がみられ、既存のワクチンが効かない可能性も指摘されている(Dr.Kitching、私信、1998年)。このため、欧州連合は1998年夏までに欧州側トルコ地域に新分離株を用いた緊急ワクチン接種を実施し対欧州ワクチンバリアを設定している(1998年口蹄疫防疫欧州委員会議事録)。以上のように、世界における最近の口蹄疫発生動向をみると、新しいウイルス株が出現して発生が継続している地域もあるが、一方において周辺国や国際機関との協力で清浄化が進みつつある地域もある。
わが国で口蹄疫であることが確認されているのは、1900~1902年の間の発生事例である。当時、茨城、東京、埼玉、千葉、石川、岐阜、兵庫、福島、新潟などの各地で国内発生があり、合計3,532頭の発病牛があったことが記録されている86)。また、1919~1933年の間には、横浜、神戸、長崎、大阪、門司、敦賀などの動物検疫所内で、中国大陸や朝鮮半島から輸入された牛に口蹄疫が摘発された事例があるが、いずれも国内伝播は阻止されている。このように、わが国では今世紀初頭に国内発生を経験したのち現在まで本病の発生を認めていない(表2)。
表2. 日本における口蹄疫発生記録
| 発生年 | 発病頭数(件数) | 発生府県又は摘発機関 |
|---|---|---|
| 1899 | 3 | 茨城(未確定) |
| 1900 | 2,322 | 東京、神奈川、埼玉、千葉、石川、岐阜 |
| 1901 | 628 | 東京、神奈川、兵庫、福島 |
| 1902 | 522 | 東京、神奈川、兵庫、新潟 |
| 1919 | 424(9) | 動物検疫所(横浜、神戸、長崎) |
| 1920 | 20(3) | 動物検疫所(横浜、長崎) |
| 1921 | 538(20) | 動物検疫所(横浜、大阪、神戸、門司) |
| 1922 | 193(12) | 動物検疫所(横浜、大阪) |
| 1924 | 13(1) | 動物検疫所(敦賀) |
| 1933 | 243(1) | 動物検疫所(門司) |
(技術の手引き4. 口蹄疫、農林省監修、日本獣医師会、1965より引用)
2) 宿主域
口蹄疫ウイルスに感受性の動物は57種にのぼり、そのうち偶蹄類が39種と最も多く、齧歯類も11種が含まれる。さらにそのうち自然感染で発病したものが31種、自然感染で抗体が検出されたものが8種、また以上の動物種を含めて実験的に感受性が確認されたものが23種ある17,69,91)。このように、口蹄疫ウイルスの宿主域は極めて広い。野生動物の中ではアフリカ水牛など長期間キャリアーとなる野生動物もみられ、その存在は本病の防疫上問題となっている4,12,48,117)。
家畜の中では、一般に牛が最も感受性が高く、次いで豚、羊、山羊の順となる。しかし、台湾をはじめ1990年代になって東南アジア地域に流行している特定のOタイプ株は、豚に高い親和性を示し(porcinophilic strain)、感染豚との同居試験でも牛は感染しないとの報告がある42)。ある流行株が特定の動物種にのみ感染しやすいという性質は、地域的にみると豚や羊において従来もみられている。例えば、1927年には北ドイツで豚に親和性が高く、牛には感染しにくいウイルス株の流行事例が報告されている。同様に、1930年代から1940年代にかけて、英国で分離されたウイルス株のなかには、豚に親和性の高いウイルス株が認められている。また、1990年代のトルコにおける口蹄疫を臨床疫学的にみると、通常症状が顕在化しにくいと言われている小反芻獣が強い症状を示したという事例も報告されている42)(1997年口蹄疫防疫欧州委員会議事録)。こうした事例は、一般の口蹄疫ウイルスの宿主域に関する考え方とは異なり、地域的にみると口蹄疫ウイルスが特定動物種に馴化することを示している。しかし、一方では流行中に抗原変異を伴って宿主域が変化、拡大することも指摘されている。事実、豚に親和性が高いという1997年の台湾株と同じOタイプが、フィリピンでは豚以外に水牛や牛にも感染した事例がある。流行株の宿主特異性は一連の流行の間でも必ずしも固定されたものではないと考えられている。
3) 伝播
潜伏期及び発病期の感染動物は、口蹄疫が発生後蔓延する際の主要な感染源になる。とくに、感染動物は病変形成前からウイルスを排出するので大きな問題となる。主な家畜の潜伏期間は、牛6.2日、豚10.6日及びめん羊9.0日である19)。潜伏期間は感染ウイルス量が多いと短かく、少ないと長くなる傾向があり、自然例では必ずしも一定していない。各家畜はいずれも水疱形成前からウイルスを排出する。その期間は水疱が出現する前の1~5日(牛)、2~10日(豚)、0~5日(めん羊)といわれる(表3)。とくに、豚の潜伏期間は長く、その間にウイルスを排出するので問題となる。さらに、豚のウイルス排出量は、ウイルス株により差があるが、一般に牛などの反芻獣に比較して100倍~2,000倍多く、高濃度のウイルスをエアロゾルの状態で気道から排出する37,38,115)。1頭の感染豚が1日に排泄するウイルス量は108ID50(ID50は感染動物が発病に要する最少感染量の推計値)を越えるが、牛、めん羊、山羊の1日ウイルス排泄量は最大でも105ID50程度である83)。一方、豚の最少有効感染量(経気道感染で102.6ID50、経口感染で105.0ID50)は、牛のそれ(経気道感染で101.0ID50)に比較して、より多量のウイルス量が必要とされる35,39,40,56,110,117)。このことから、口蹄疫ウイルスの感染疫学において、牛をdetector(検出動物)、豚をamplifier(増幅動物)とみなす概念がある68)。このように、豚は本病の蔓延にきわめて重要な役割を果たしている。豚の飼養密度が高い地域に発生すると、地域のウイルス汚染度が高まり、空気伝播や風による伝播が起こりやすくなって、防疫が困難になるとの指摘がある76)。このほか、発病動物の口や蹄に形成される水疱や乳汁にも多量のウイルスが含まれ、糞尿にもウイルスが排出される。感染動物が排出したウイルスは畜舎や農場内を汚染し、直接あるいは間接的な接触伝播を起こす。牛乳には水疱形成の平均4日前からウイルスが排出されるため、潜伏期に搾乳した牛乳は口蹄疫の汚染源になり得る。潜伏期の牛乳のウイルス量は106.6TCID50/mlにのぼり、その0.1mlで豚が経口感染するために必要十分なウイルス量を含んでいる20,35)。現在通常実施されているHTSTやUHTによる牛乳の滅菌方法は口蹄疫ウイルスを完全には不活化しない15,25,35)。このため、口蹄疫が発生した際に大量に生じる汚染牛乳の処分方法が問題になる。犬、猫、鶏、ネズミ、野鳥などの非感受性動物による機械的伝播、汚染された飼育器具、機材、飼料、人、車両などを介した間接的な伝播も多い(表3)。
表3. 各種動物における潜伏期間中のウイルス排出
| 動物 | 材料の由来 | 排出ウイルス量 logTCID50、(平均) | 排出開始から水疱形成 までの日数(平均) | 潜伏期間(日) |
|---|---|---|---|---|
| 若雄牛 | 咽頭 | 1.9-5.3 (3.6) | 0-5 (2.5) | 6.2 |
| 咽頭 | 2.5-5.5 (3.5) | 2-5 (2.7) | ||
| 血液 | 1.0-4.1 (2.2) | 1-2 (1.8) | ||
| 乳牛 | 乳汁 | 1.0-5.2 (3.0) | 1-4 (2.2) | |
| 直腸 | 1.0-1.6 (1.3) | 1 (1.0) | ||
| 膣 | 2.9-3.3 (3.2) | 1 (1.0) | ||
| 豚 | 咽頭 | 0.7-3.5 (2.2) | 2-10 (5.0) | 10.6 |
| 直腸 | 0.6-2.6 (1.3) | 0-7 (4.2) | ||
| めん羊 | 膣 | 0.6-3.0 (1.6) | 0-7 | 9.0 |
| 咽頭 | 1.2-3.5 (2.9) | 0-5 (2.5) |
Burrows, R.(Vet. Rec. 82:385, 1968)
口蹄疫ウイルスは、陸上では60km、海上では250kmもの距離を風で伝播すると指摘されている51,87)。風によってウイルスが伝播することは、1930年代から指摘され37,39,40,51,105,106)、1967/68年の英国での発生でその現象が確認されている59,60)。それによると、多数の発生が原発農場の風下に存在し、それらは雪や雨を伴う風向きに一致していたという。その後、フランスからドーバー海峡を越えて英国へ(1974年、1981年)、デンマークからスウェーデンへ(1982年)など主として欧州で風による伝播が記録されている。欧州以外でもヨルダンからイスラエルへ(1985年)同様の事例があった87)。しかし、口蹄疫ウイルスの風による伝播には、高湿度、短日照時間、低気温等の一定の気象条件が必要である59)。そのうち、とくに湿度はウイルスの自然環境での生残に重要で、湿度60%以上ではウイルスは数時間は生残して、風による伝播を助長する87)。最近では、風による伝播要因の解析が進み、感染動物種とそれらの推定ウイルス排泄量(殺処分までの期間を含む)、飼養施設数、気象観測データ、地域の地理特性などをもとに、疫学シュミレーションで半径10km程度の範囲でウイルスの蔓延を予測し、防疫活動に役立てる試みが行われている83)。
口蹄疫ウイルスの国際伝播では、感染家畜、汚染農・畜産物の流通、船舶や航空機の汚染厨芥、風や人、鳥によって物理的に運ばれるものなど原因は様々である。過去627例の世界の口蹄疫発生原因を解析した米国農務省の報告によると87)、口蹄疫の初発原因は、汚染畜産物と厨芥が最も多く(66%)、次いで風や野鳥(22%)、感染家畜の輸入(6%)、汚染資材と人(4%)、不活化不充分なワクチン(3%)及び野生動物(<1%)となっている(表4)。
表4. 過去における口蹄疫の初発原因(1870~1993年)*
| 感染源 | 発生頻度(%) |
|---|---|
| 汚染肉・畜産物・厨芥 | 66 |
| 風による伝播・渡り鳥 | 22 |
| 家畜の輸入・移動 | 6 |
| 汚染資材、器具、人 | 4 |
| ワクチン(不活化不充分のもの) | 3 |
| 野生動物 | <1 |
*期間中の発生件数: n=627(USDA, 1994)
感染動物はウイルス血症を起こすため、皮膚、臓器、筋肉、血液、リンパ節、骨などすべての組織にウイルスが含まれ感染源となる24,56,71,72,115)。一般にと殺動物では、死後硬直が始まり最大硬直期に至るまで、解糖産物である乳酸が筋肉内に蓄積してpHが低下する。このため、筋肉内に含まれる口蹄疫ウイルスは徐々に不活化される。牛の筋肉ではこの傾向が顕著で、牛の筋肉内pHは、2°Cではと殺後3時間で低下しはじめ、通常48時間でpH5.5近辺まで低下する(極限pH)11)。しかし、乳酸の生成によるpHの低下は豚肉では牛肉ほど明瞭なものではなく、さらに個体ごとにばらつきがみられる43)。豚の筋肉内pHは、実験成績では37°Cでは7時間以内にpH5.5まで下がるが、一般的なと体処理条件ではpH5.7以下にはならない場合が多い43)。筋肉をと殺後直ちに冷凍した場合にも、乳酸の生成は停止するのでウイルスは不活化されないことになる。また、大量のウイルスを含むリンパ節、骨髄、筋肉内の大きな血管に残存する血ぺいなどは、と殺後も乳酸によるpHの影響を受けないので、ウイルスは長期間残存する。牛の例では、リンパ節、骨髄、血餅中のウイルスは、4°Cでは3~7ヶ月間不活化されていない71)。また、実験感染豚を用いて塩漬乾燥調理したハム、ベーコン、ハム脂肪及び付属骨髄には、ウイルスはそれぞれ182日、190日、183日、89日間生残する78,81,88)(表5及び表6)。
表5. 口蹄疫ウイルスの生存期間(1)
| 対象物 | 環境状況 | 生残期間 |
|---|---|---|
| 牛肉 | 4°C | 3日 |
| -20°C | 90日 | |
| 急速冷凍 | 240日 | |
| 豚肉 | 1~7°C | 1日 |
| 冷凍 | >55日 | |
| 骨髄 | (牛)1~4°C | 30週 |
| (豚)1~7°C | 6週 | |
| 腸管 | (豚)1~7°C | 250日 |
| リンパ節 | (牛)1~4°C | 120日 |
| (豚)1~7°C | 70日 | |
| 舌(牛) | 冷凍 | 11年 |
| 牛乳 | 72°C, 30秒 | 生残 |
| 堆肥(牛) | 夏 | 1週 |
| 冬 | 24週 | |
| 敷料(ワラ等) | 4週 | |
| 衣服, 靴 | 夏 | 9週 |
| 冬 | 14週 | |
| 飼料(ふすま) | 20週 | |
| (乾草) | >200日 |
(USDA, 1994より抜粋引用)
表6. 口蹄疫ウイルスの生存期間(2)
| 対象物 | 環境状況 | 生残期間 |
|---|---|---|
| 内臓肉(豚) | チルド | 30日 |
| 内臓肉(豚) | 冷凍 | 210日 |
| パルマハム | 170日 | |
| セラーノハム | 182日 | |
| イベリアンハム | 168日 | |
| イベリアンショルダーハム | 112日 | |
| イベリアンロイン | 42日 | |
| 塩漬ベーコン | 190日 | |
| ハム脂肪 | 183日 | |
| ソーセージ | 56日 | |
| サラミ | 7日 | |
(FarezとMorley, 1997より引用)
このように、汚染畜産物を介した口蹄疫の侵入リスクを科学的に評価する危険度分析手法の基礎資料として、感染動物を用いて実際に畜産加工品を調製し、その中に含まれるウイルス生残条件とその期間が検討されている16,57,78,81,87,88,120)。なお、ウイルスの生残を最終的に判定するためのウイルス分離法には、一般的に細胞培養より検が高い感受性動物への接種試験が用いられる。
4) キャリアー
牛、羊、山羊、水牛、シカなどの反芻獣では、感染耐過後またはワクチン接種後の感染で、免疫を獲得した状態でウイルスが食道や咽頭部位に長期間持続感染するキャリアー化の現象が認められる3,4,18,27,48,49,95,117,119)。牛ではキャリアー状態が感染後2.5年間持続した例があり、キャリアー動物が感染源になった発生事例もみられている30,117)。このため臨床症状を示さないキャリアーの存在は口蹄疫の防疫上大きな障害になる。キャリアー動物におけるウイルスの増殖部位は、咽頭粘膜、扁桃咽頭部、軟口蓋、食道前部などで18,19)、表7に示したように、回収ウイルスには遺伝学的にも生物学的にもその性状に変化がみられる50,108,117)。
表7. 持続感染動物から回収されたウイルスの性状変化
| 動物種 | タイプ | 生物学的性状の変化 | その他 | ||||
|---|---|---|---|---|---|---|---|
| 遺伝学 的変化 | 抗原変異 | 感染性 | 病原性 | プラック サイズ | |||
| 牛 | A, C | + | |||||
| 牛 | SAT3 | + | |||||
| 牛 | SAT1 | - | |||||
| 牛 | C | + | + | pHと熱感受性 | |||
| 牛 | O | + | - | pHと熱感受性 | |||
| 牛 | O | + | + | + | インターフェロン 産生能 | ||
| 羊 | A5 | + | |||||
| 牛 | A5 | + | |||||
| 牛 | C3 | + | |||||
| 牛 | C3 | + | + | ||||
| 牛 | O | + | ± | ||||
| アフリカ水牛 | SAT2 | - | |||||
| アフリカ水牛 | SAT2 | + | ± | ||||
+:変化あり、-:変化なし、±:評価保留(Thomson, G.R. 1996より引用)
また、キャリアー動物から回収される咽頭食道粘液中のウイルス量は、牛で100.3~2.9TCID50/ml、アフリカ水牛では104TCID50/mlにのぼり3,4,27,117)、キャリアー化した動物からのウイルス伝播は、持続感染したウイルス量がある閾値を超えた場合に起こるとされている61)。なお、1992年に行われた口蹄疫のキャリアーに関する欧州委員会の統一見解は以下の通りである95)。1)口蹄疫ウイルスを連続的または断続的に4週間以上産生排泄する反芻獣をキャリアと定義する。2)キャリアー化は、感染耐過、ワクチン接種後の感染あるいは不顕性感染した反芻獣に起こる。3)キャリアー動物から回収されるウイルスは抗原及びその他の生物性状に変化がある。4)キャリアーとなる期間は動物種とウイルス株によって異なる。その期間はアフリカ水牛が最も長く(最長5年)、牛(同2.5年)、羊と山羊(同9月)及びシカ(同11週)の順に短くなる27,48)。5)キャリアー動物が感受性家畜へウイルスを伝播したという実験的確証は乏しいが、キャリアー動物が口蹄疫の発生に関与したという野外例が確認されており、移動などのストレスがキャリアー動物からの伝播を促進すると考えられる。6)キャリアー動物の輸入は、ワクチン接種を実施していない清浄国にとって大きなリスクとなる。
これに対して、豚はキャリアーにならないとする見方が一般的である。すなわち、呼吸器から感染した豚では肺でウイルスが増殖するが、発病後8~10日でウイルスの排出は停止し、その後肺と咽頭のいずれにおいてもウイルスは検出されなくなり持続感染は成立しない。イボイノシシやヤブイノシシなど豚属の野生動物も豚と同様の反応を示すという38,117)。
このように口蹄疫のキャリアーは反芻獣にみられるが、豚属にはみられない。その原因やキャリアー化の機序そのものは現在のところ判明していない。現象的にみれば、キャリアー化した牛は、キャリアー化しなかった牛に比較して、血清と食道・咽頭粘液のいずれにおいても高い中和抗体価を維持している30,102)。このことは、キャリアー化する牛では、局所の免疫が有効となる前に食道、咽頭の特定部位でウイルスが感染増殖して持続感染が成立することを示している。その後局所のウイルスが消失して、抗体価が低下、消失するまで、数ヶ月から数年にわたりウイルスは持続的に免疫刺激を与えているものと推測されている30)。一方、キャリアー化しない豚では、初感染後ウイルス排出が停止する7~10日目に中和抗体価がピークとなるが、その後抗体は1~6ヶ月以内に消失し、感染耐過豚でも免疫の持続は牛のそれに比較して明らかに短い。このように、少数の例外を除けば、キャリアー動物は常に抗体を保有しているといえる30)。キャリアー動物においてウイルスが検出されるにもかかわらず、抗体が検出されないという少数の例外は、いずれも実験的確証はないが、ひとつは免疫寛容が成立した個体である場合と、もうひとつは高率に感染している牛エンテロウイルスの外殻と口蹄疫ウイルスゲノムを持つ雑種ウイルスができて、これが持続感染した個体である場合の2通りの仮説がある30)。後者では、ウイルス分離では培養中に口蹄疫ウイルスが出現するため、またPCR法では口蹄疫ウイルスゲノムそのものが検出されるため、口蹄疫ウイルスに対する抗体を持たない個体で、あたかも元々口蹄疫ウイルスに持続感染したようにみえると考えられている。
3. 臨床症状
1) 牛の症状
牛の潜伏期は平均約6日であるが、前述したように潜伏期間は感染ウイルス量によって異なる。この潜伏期をおいて通常、発熱、流涎、跛行などの症状がみられる。乳牛では発病前から泌乳量が減少するので、最初は乳量の減少で異常に気付くことが多い。水疱は、舌、歯齦、口腔粘膜、鼻孔粘膜、蹄間部、乳房、乳頭などにみられる。蹄部の水疱は細菌の2次感染を受けやすく、趾間腐爛と間違えやすい。こうした水疱も短期間の内に上皮が剥離し、潰瘍やび爛に移行する。幼牛は心筋炎により高い死亡率を示すが、一般の牛の死亡率は低い。しかし、乳牛、肉牛のいずれも運動障害と採食困難に陥り、産業動物としての生産性は著しく低下し、廃用になるものも多い。新生子牛は心筋炎で死亡する。また、めん山羊にも水疱が同部位に形成されるが、症状は牛ほど明瞭ではない58,115)。
2) 豚の症状
豚の潜伏期も感染ウイルス量によって異なる。豚では、最初に発熱(40.5°C以上)、食欲不振及び嗜眠がみられる。さらに、鼻鏡や鼻腔の皮膚粘膜、舌、口唇、歯齦、咽頭、口蓋などの粘膜と蹄部に水疱が出現する。豚では蹄部、とくに蹄冠部、趾間、副蹄の水疱形成が顕著である。このため跛行によって異常に気付くことが多い。また、起立しようとして犬座姿勢をとる。母豚には乳頭にも水疱がみられる。水疱は初期には小さいが次第に拡大し透明感のある多量の水疱液を満たす。その後、6~24時間で水疱は自壊し、び爛、仮皮形成を経て、細菌の2次感染がなければ7~14日の経過で回復する。しかし、水疱形成が重度に及ぶと、出血を伴って蹄冠が脱落することも多い。台湾の事例では蹄部の水疱形成が顕著で、落蹄も多数みられ、そのための疼痛から跛行、歩行及び起立不能などを起こしている。また、舌や口腔粘膜の水疱も顕著で、重症例では採食、採水障害を起こし、こうした運動障害は、豚の体重減少、脱水、衰弱などを招き、生産性は著しく低下する。また、事例は少ないが妊娠豚は流産することがある。清浄国などで免疫を全く持たない場合の感染率は100%に近い。致死率は、通常5%未満であるが、新生豚では心筋炎を起こしやすく、その致死率は50%以上に及ぶ58,115,118)。
3) 類症鑑別
口蹄疫とよく似た伝染病として、豚では豚水疱病、水疱性口炎、水疱疹及び豚痘などのウイルス病がある。また、牛では、牛伝染性鼻気管炎、牛ウイルス性下痢・粘膜病、ブルータング、趾間腐爛などの類似疾病も一見口蹄疫に似た症状を示すので注意する必要がある。なお、豚水疱病や水疱性口炎は口蹄疫と同様にわが国には発生がなく、いずれも臨床的に口蹄疫と区別が出来ない。これらの水疱性疾病が発見された場合には、口蹄疫を想定した対応が必要で、最終的には後述する実験室内検査を実施する必要がある。
4. 病理発生と病変
1) 病理発生
牛での観察をもとに、口蹄疫ウイルスの伝播はウイルス粒子を含むエアロゾルの吸引によって起こるとされている109)。しかし、牛の感染試験では、舌上皮内、筋肉内、気管内、眼結膜上、皮下、静脈内、鼻腔内、子宮内、乳腺内、経口のいずれの経路からでも感染が成立する115)。また、牛では、ウイルスの呼吸器深部への到達は、ウイルスを含むエアロゾルの大きさに関係し、平均3~6ミクロンのエアロゾル粒子が最も到達しやすいといわれる。しかし、豚では野外例の観察から初感染は経口感染によるとの指摘もある113,117)。精液にもウイルスが含まれるため、汚染精液を介して人工授精や交配で感染が成立する23,74,80)。
感染後のウイルス排出を牛、豚及びめん羊で比較したBurrowsの報告によると(表3)、感染家畜のウイルスは、いずれも水疱形成の相当以前から検出されるが、咽頭部からの検出が最も早期で、血液、乳汁、直腸、膣からの検出時期より早い19,21)。このことから、ウイルスは体内で最初に咽頭部で増殖し、次いで血流に乗ってその他の組織、器官に到達するものと考えられている。血流を介してウイルスが到達した後のウイルス増殖部位は、リンパ節、消化管、筋肉とくに心筋、乳腺、皮膚、口腔粘膜上皮、膵臓、脳下垂体などである。このうち筋肉では肉眼的にも組織学的にも病変が認められ、とくに若齢獣は心筋炎を起こして水疱形成前に高率に突然死する。牛では、ウイルス血症は最初の水疱が形成される1日前または形成当日から3~5日間継続する21)。こうした急性期の感染牛の組織内ウイルス量は極めて大量で、その最高値は心筋で1010ID50/g、リンパ節で108.2ID50/g、血液で105.6ID50/gとなる72)。豚の場合、感染ウイルスは最初咽頭から肺にかけての呼吸器で大量に増殖し、牛や羊の数百倍から数千倍のウイルスを排出する。その後、ウイルスは肺と付属リンパ節のマクロファージによって皮膚、粘膜及び心筋に到達して増殖する58)。さらに、ウイルス血症が3~5日持続し、鼻、口、蹄などに水疱を形成する。豚では水疱形成はストレスや機械的刺激も誘因になる。
2) 病変
水疱病変を肉眼的に見ると、水疱は最初境界明瞭で次第に水疱液が貯留する。組織学的にみると、水疱は角質細胞の水腫と壊死をともなって有棘層に形成され、やがて上皮細胞は基底層から剥離する。水疱形成が不充分な場合には、角質層を通して乾燥する。基底層に病変が認められることはない。細菌の二次感染がなければ、上皮は数週間で修復される。しかし、蹄部の水疱は二次感染を起こしやすく、蹄冠の剥離が生じると回復に長時間を要する。幼若豚の心筋病変では、好中球の浸潤を伴う心筋の変性壊死がみられ、虎斑心と呼ばれる特徴的な変性壊死病変を形成する58,115,118)。
5. 診断
1) 世界の口蹄疫診断の現状
口蹄疫の発生は畜産物の国際流通に多大の影響を及ぼす。このため、各国が検疫検査に使用する診断手法を統一する必要があって、材料の採取、輸送、検査手法はOIEによってマニュアル化されている41)。わが国を含めて各国はこの診断マニュアルに準じた診断方法を採用している。またOIE加盟国には、診断が確定すると国際機関と関連国に対して迅速な通報義務が課せられており、その後関連国との間で防疫のため種々の国境措置が取られることになる。したがって、口蹄疫の診断は各国とも国家レベルで実施することになっている。また、迅速な国内防疫を図るためには、単に口蹄疫であることを診断したのみでは意味がない。タイプの決定、ワクチン株との関係、清浄化対策など迅速な防疫に不可欠な様々な診断手法が必要になる。その中には、各国で実施できる段階のものもあれば、国際機関との連携が必要になるものもある。さらに、口蹄疫ウイルスの抗原は変異を起こしやすく、地域的にみればかつて流行の主流であったウイルスが消える一方で、新しい抗原性状を示すウイルスが絶えず出現している。このため、地球規模の診断体制が必要で、OIEと国連食糧農業機関(FAO)は、World Reference Laboratory for Foot-and-Mouth Disease(以下口蹄疫WRLと略;英国家畜衛生研究所のPirbright Laboratory内に設置)を置くとともに、各地域にRegional Reference Laboratory for foot-and-mouth disease(以下口蹄疫RRLと略)を指定して、その診断業務を分担している41)。1996年現在で口蹄疫RRLは、ロシア(全ロシア家畜衛生研究所、ウラジミール)、ボツワナ(ボツワナワクチン研究所、ガベロン)及びブラジル(汎アメリカ口蹄疫センター、リオデジャネイロ)の4機関が指定されている。分離株間の近縁関係はワクチン株の選択と流行疫学の把握に重要であることから、英国に設置されている口蹄疫WRLでは、ほぼ世界全地域の流行株について、抗原型と遺伝子型の双方の解析を担当しその情報を世界に提供している41)。
2) 日本における口蹄疫の診断
わが国は口蹄疫のワクチンを使用していない清浄国である。従って、ワクチン接種を行っている地域で問題になるキャリアー動物の問題はなく、ウイルスの隠蔽(masked infection)は起こらないことを前提に、感染動物や発病動物の摘発を行う。口蹄疫を疑う疾病が発生した場合には、水疱病変の分布や形状などの臨床観察のほか、本病が最も伝染しやすい疾病であることを念頭において、同居家畜、農場内及び周辺農場への伝播状況などの疫学的状況を正確に把握する必要がある。また、患畜は病変形成の前からウイルスを排泄するので、発生農場を中心に数週間前からの家畜の出荷先と導入元を正確に把握して追跡調査を実施する必要がある。口蹄疫の伝播は速く、対応が遅れると被害が広域に及び被害が増大するので、効果的な防疫対策をとるには疾病の摘発から診断までを迅速に実施する必要がある。日本における口蹄疫の診断は、「海外悪性伝染病防疫要領」に基づいて実施する。病性鑑定材料の採材と運搬方法も、この要領に細かく記載されている。また、口蹄疫の実験室内診断は、わが国では農林水産省家畜衛生試験場海外病研究部(東京都小平市)の高度封じ込め施設内で安全に実施するように定められている。
口蹄疫を疑う疾病が発生したときには、まず最寄りの家畜保健衛生所あるいは役場等に通報する。また、報告を受けたこれらの機関は速やかに農林水産省に通報する。病性鑑定材料の採取と運搬に先立っては農林水産省と協議する。病性鑑定材料には、可能な限り新鮮な水疱上皮を採取する必要がある。口蹄疫の診断材料は、同一農場であれば家畜個体ごとに採取する必要はなく、複数の個体から新鮮な水疱上皮を集め採材してかまわない。上皮が破裂していない場合には水疱液も診断材料として利用できるので、注射器等で別途内容液を採取する。水疱上皮は2cm角または合計1g以上が必要で、家畜保健衛生所の病性鑑定施設に準備されている保存液に浮遊させる。口蹄疫ウイルスは酸性や塩基性で容易に不活化されるので、保存液のpHは7.2~7.6の間に厳密に調製する。保存液には、滅菌した1/25Mリン酸緩衝液に等量のグリセリンを混ぜたものを使用する。幼獣等の死亡例が出た場合には、心筋、リンパ節、主要臓器などを病性鑑定材料に使用できるが、汚染の拡大防止には細心の注意を払う必要がある。採材のために剖検を要する場合には、焼却や集中的な消毒が可能な病性鑑定施設等で実施すべきである。病性鑑定材料を保存液を満たした容器に入れ、密栓したのち、表面を4%炭酸ソーダ液等で消毒する。破損や水漏れのないように2重包装して、凍結させないように冷蔵保存して運搬する。また、血液も採取して水疱材料と同様に冷蔵保存で運搬する。運搬には、上記の要領に従い連絡員が持参するが、空輸等最も迅速な方法を用いる。
3) 診断手法
病原学的検査では、同時にタイプ分類が可能な抗原検出用のエライザや補体結合(CF)反応、ウイルス分離及びPCR法が、また血清学的検査手法では、中和試験、抗体検出用エライザ及びVIA抗原などウイルスの非構造蛋白質を用いた抗体検出法が、それぞれ標準的な手法になっている41,45,73)。なお、口蹄疫を疑う疾病の診断では、実際には口蹄疫以外の水疱性疾病との類症鑑別も同時に実施する。
(1)病原学的検査法: CF反応は1952年に開発された抗原検出法で、当初は試験管法であったが、現在では微量化したマイクロ法になっている。口蹄疫ウイルスのタイプ分類にはウイルス抗原の立体構造が重要で、で抗原・抗体反応を行うCF反応の信頼性は現在でも高い。わが国では、口蹄疫7タイプに豚水疱病ウイルスと水疱性口炎ウイルス血清型を加えて、水疱性疾病の類症鑑別も可能なCF反応を実施している。しかし、CF反応における抗補体作用や検出感度の問題を解消するため、現在では間接エライザ・サンドイッチ法(Indirect sandwich ELISA)がこれに代わりつつある45,98,121)。この方法では、口蹄疫ウイルスの7種のタイプと豚水疱病ウイルスに対する捕捉抗体をプレートに固相化し、次いで検査材料(組織乳剤や感染培養液)、タイプ特異検出抗体、標識抗体及び基質の順に反応させる。結果は各タイプ及び豚水疱病の陽性抗原との比較で判定する。
口蹄疫ウイルスの分離には、かつてはモルモット、マウス及び牛などの感受性動物を用いた動物接種を実施してきた45)。しかし、動物接種法は、経費と時間を要するため現在は細胞培養がウイルス分離に用いられている。細胞培養には、歴史的に初代豚腎細胞、初代牛甲状腺細胞、ハムスター腎由来株化細胞のBHK細胞、豚腎由来株化細胞のIBRS2細胞などが用いられる。分離株の宿主親和性を考慮して、由来動物種の異なる培養細胞を用意する必要もある。また、口蹄疫ウイルスとその類似疾病の感受性を考慮して、細胞種を組み合わせ分別分離を行う。なお、分離ウイルスは上記の抗原検出法で同定する。また、キャリアー動物からのウイルス分離材料は、金属製小カップで咽頭から食道上部の粘液を掻き取るプロバング法で採取する41)。キャリアー動物はウイルスを中和する抗体を保有するので、採取材料は速やかに凍結冷却したのち運搬してウイルス分離に用いる。
また、キャプシド蛋白質1Dまたは非キャプシド蛋白質3D遺伝子領域を標的としたPCR法による遺伝子診断法も実用化され、現在では不可欠の口蹄疫診断法になっている70,82)。キャプシド蛋白質1D遺伝子領域を標的としたタイプ決定が可能であるというPCR法も報告されているが2,97)、限られたウイルス株を対象にした実験段階の成績にとどまり、野外材料への応用には誤診断の可能性があるため現在のところ普及していない。
(2)血清学的検査法: 中和試験にはIBRS2細胞などの感受性株化細胞を使用する。しかし、生ウイルスの使用が禁止されているわが国では中和試験は実施できない。口蹄疫ウイルスの抗体検出用ELISAは従来から多数の試みがある。しかし、抗原の立体構造が保たれ非特異反応が少ないこと、極めて多種類の感受性宿主動物についても、単一の反応系で抗体検出が可能なことなどを検討した結果、現在液相競合エライザ・サンドイッチ法(Liquid phase blocking ELISA)が標準法になっている53,54,55)。この方法は、まず、抗体検査する目的タイプごとに、被検血清と一定量の口蹄疫ウイルス不活化抗原とをCFプレート上で混和、一次の抗原抗体反応を液相で実施する。その後、被検血清に含まれる抗体で消費された抗原量を上述の間接エライザ・サンドイッチ法で測定し、競合的に抗体の有無と定量を行うものである。スクリーニング法と抗体価測定法があり、抗体価測定では抗体価45倍以上を陽性とする。
VIA抗原などのウイルス非構造(NS)蛋白質は、タイプ間の共通抗原として、またウイルス感染を証明する抗体検出用の抗原に利用されている。すなわち、NS蛋白質に対する抗体は、理論的にはウイルス感染時にのみ産生され、キャプシド(構造)蛋白質のみからなる不活化ワクチンで免疫した個体にはNS蛋白質に対する抗体は産生されない。このため、NS蛋白質に対する抗体の検出は野外ではウイルス感染を意味し、その抗体検査によりワクチン接種動物と感染動物の識別が可能となる。このため、NS蛋白質に対する抗体検査手法は、ワクチン接種地域におけるキャリアー動物の摘発手法になる可能性があって、各国で研究が行われている。これまで、NS蛋白質のL、2B、2C、3A、3B、3C、3D、3ABCなどを遺伝子組換え技術や化学合成法で作製し、これらを抗原とした免疫拡散法、エライザ及びウェスタンブロット法などの抗体検出法が検討されている13,84)。しかし、こうしたNS蛋白質を抗原とする抗体検出法には問題も残されている。すなわち、上記の各NS蛋白質の中には、3D蛋白質(VIA抗原)のようにウイルス粒子に微量が組み込まれ、結果としてワクチンを頻回接種した動物にも抗体が検出されるため特異性が乏しいものや89)、免疫原性が低く抗体が持続しないもの(L、2C蛋白質)などが存在する。1994年~1997年にかけて、欧州委員会で実施されたNS蛋白質を利用した抗体検出法に関する共同研究によると(Dr.Mackay, 私信)、3ABCポリ蛋白質を抗原とした抗体検出法が最も有望視されている。しかし、現在のところ、こうした抗体検出法のみで抗体識別を行いキャリアー動物の摘発を図るのは困難で、プロバング法やPCR法との併用が不可欠と考えられている。しかしながら、NS蛋白質を用いる抗体検出法は、万一口蹄疫が発生した場合にもその後の清浄化技術に不可欠で、その研究は清浄国においても重要性を増している。
4) ウイルス株の抗原解析
タイプあるいはサブタイプの決定などウイルス株間の抗原の比較は、従来はモルモットで作製した免疫血清を用いて、補体結合反応または中和試験で行われてきた46)。この方法では、2株間の抗原的相関度Rは、R=(r1×r2)1/2×100で求める。rはヘテロ血清とホモ血清の抗体価の比率で示され、2種類の抗原についてr1とr2を求める。その結果、R値が70%以上を示した場合に同一タイプに分類され、ヘテロワクチンが有効とみなされる。一方、R値が32%以上70%未満の場合には異なるサブタイプに分類され、ヘテロワクチンの効果は不充分と判定される。またR値が32%未満の場合には、その程度に応じて著しく異なるサブタイプか、まったく異なるタイプに分類され、ヘテロワクチンの効果は無効と判定される。ところで、以上の分類方式は1967年に口蹄疫WRLにより提案されたものであるが、その後サブタイプ分類に関する諸問題が生じてきた、すなわち、(1)測定誤差や免疫動物の個体差によりR値の変動が時にサブタイプ分類の枠を越える場合があること、(2)ワクチン株の選択には広い抗原相関度を持つdominannt株が良いが、r1とr2の平均値で示されるRは必ずしもそのことを反映しておらず、ワクチン株の選択という観点からはむしろrを重要視すべきこと、(3)将来限りなく新しいサブタイプが出現する可能性があって、分類学上混乱が生じる、などの問題点である。このため、1976年に同じく口蹄疫WRLから、既存のサブタイプは存続させるが、将来のサブタイプは疫学的に重要なものに限定するとともに、ワクチン株の選択という観点からはR値よりr値を重視するよう提案がなされている46,68)。さらに、その後モノクローナル抗体による抗原決定基の解析が進んだこと66)、流行疫学の分析に遺伝子の相同性解析に基づく分子疫学手法が加わったこと10,77)などから、現在の口蹄疫WRL責任者であるKitchingらは、1988年に従来から実施してきた分離株のサブタイプ表示を中止し、株間の抗原関係の解析に液相競合エライザ・サンドイッチ法を用いることを提案した64,65)。現在ではこの方法により抗原解析が実施されているが、こうした提案の背景には、サブタイプ分類に関する従来からの問題点に加えて、抗原決定基の構造解析が進みサブタイプ分類が実際上意味を持たなくなったこと、ワクチンバンクなど新しい防疫システムが普及し、免疫血清の作製に時間を要する従来のサブタイプ分類は、バンクワクチン株を緊急に選択するためには迅速性に欠けることなどがある64,65)。新規提案された方法では、株間の抗原関係r1は、牛標準血清に対するヘテロウイルス株とホモウイルス株の抗体価の比で表される。実際にはr1値が0.7を越える場合に、相互のウイルス株の間に交差感染防御能があると推定される。さらに、分離株を血清型/分離地/株番号/分離年/抗原型(R;抗原的に最も近縁な参照株またはワクチン株番号)/遺伝子型(G;遺伝的に最も近縁な参照株番号)で表示する統一命名法も提案されている64,65)。抗原型はワクチン株の選択など実際の防疫活動に重要な情報を提供する。一方、遺伝子型は抗原決定基を含む1D遺伝子領域(VP1をコード)の相同性解析に基づくもので、ワクチン株との関係に加え、次項で示すように伝播経路の究明など流行疫学の解析に活用されている。さらに、各地の流行株に対するモノクローナル抗体を一元的に収集し、そのパネルを作製してより迅速にウイルス抗原の解析が実施できるよう計画が進められている46,61)。
5) ウイルス株の分子疫学
ウイルス株間の遺伝学的な近縁関係の究明は、国際的なウイルスの伝播経路を明らかにする重要な手法となっており、地球規模での口蹄疫の防疫に役立つ101)。従来手法では、ウイルス蛋白のポリアクリルアミド電気泳動やRNaseT1フィンガープリント法による塩基の泳動パターン解析が用いられてきたが28)、手法が複雑で時間を要するばかりでなく、解析も複雑であること、ウイルスRNAのごく一部の比較に留まることなどの問題もあって、今ではウイルスRNAの相同性解析が行われるようになった。とくに、RT-PCR法で増幅した特定部位(1D領域)の相同性解析手法は、微量のウイルス材料でも解析が可能であるばかりでなく、迅速に株間の遺伝的近縁関係を求められるという利点がある46,61)。1997年の台湾における口蹄疫発生でも、口蹄疫WRLは発生後直ちにこの手法で分離株が近年の東南アジアの流行株に遺伝的に近縁であることを明らかにしている。
6. 免疫とワクチン
1) 感染免疫
口蹄疫ウイルスのひとつのタイプに感染耐過した動物は、そのタイプに対して感染防御するが異なるタイプに対しては感染防御しない。牛の実験では、感染耐過すると中和抗体と感染防御能は4.5年~5.5年間持続する。感染防御能は主に液性免疫に依存し、その免疫応答もタイプやサブタイプに特異的である。牛ではIgMは感染後3~5日で検出され、5~10日でピークに達するが、長期間は持続しない。IgG1とIgG1は、IgMより4日遅れて出現し、感染後15~20日で最高値に達する。中和抗体の長期間の持続は主にIgGによるものである。粘膜上の感染免疫も主に牛で調べられている。粘膜上の中和抗体の主体はIgMとIgAで、感染後7日で咽頭液に検出される。感染後20~60日でも咽頭液に中和活性を持つIgAが検出されるが、これは局所で産生されたものと考えられている。キャリアー化した反芻獣の中和抗体価は、血清と咽頭液のいずれにおいても、キャリアー化していない個体のそれより高く長期間持続する。これは持続感染したウイルスの免疫刺激が継続するためと考えられている。感染後の細胞性免疫の関与は最近研究が開始されたばかりで体系的な解明はなされていない30)。
めん羊では、中和抗体は感染後60時間で出現し、その力価は10日後に最高値に達する。その後抗体価は低下し始めるが、実験成績によると147日後まで中和抗体は存続している。しかし、中和抗体を持ちながらも、めん羊は最高9ヶ月、山羊は1ヶ月までキャリアーとなってウイルスが回収できる30)。
豚では、血清中和抗体価は感染7~10日後にピークに達したのち、28日までに急激に低下し、4ヶ月後には消失する。感染耐過豚に3~6ヶ月後攻撃接種すると、その半数が感染防御せず発病するという。鼻腔粘膜上の中和抗体も血清中のそれと同様の経過をたどり、ウイルス感染後50日ほど持続するに過ぎない30)。このように、豚は牛に比較して感染抗体の持続期間が短い。豚がキャリアー化しないこととの関係で興味深い。
2) ワクチン免疫
口蹄疫ウイルスの感染と同様にワクチン接種による免疫応答にも、多様な変動要因が関与している(表8)30)。
表8. 口蹄疫ウイルス及びその不活化ワクチンに対する宿主免疫応答に及ぼす変動要因
| 誘導要因 | 応答要因 | ||
|---|---|---|---|
| 宿主 |
動物種 品種 個体(とくにMHC) 年齢 健康状態(重複感染症) 生理状態(妊娠、泌乳) ストレス要因(気候、飼育環境) 免疫状態(移行抗体) |
抗体 |
特異性(抗原決定基の認識) 親和性 アイソタイプ(Fcレセプター保有細胞の認識度) 半減期 異種抗体との相互作用 力価と分布 |
| ウイルス |
感染量と免疫量 経路 用量 純度(外来蛋白質の有無) ウイルス株(理化学及び抗原性状) アジュバント |
細胞 |
数と密度 分布とトロピズム タイプ(T、B細胞、貪食細胞) サブセットの比率 半減期 |
(Doel,T.R. 1996より引用)
このため、口蹄疫ワクチンによる宿主の免疫応答を一律に論じるのはきわめて困難である。また、口蹄疫ワクチンの免疫に関する研究は従来牛を対象に実施されたものが多く、豚やめん山羊を対象とした研究は乏しい。しかし、近年牛以外の家畜のワクチン免疫に関する研究も盛んに行われるようになっている。
口蹄疫ワクチン接種後の免疫グロブリンの消長をみると、牛では、ワクチン接種後2~4日でIgMが出現し80日間以上持続する。ワクチンで誘導されたIgMの力価には明瞭なピークはみられないが、感染免疫のそれより高力価である。IgM抗体は中和試験でもタイプ間に交差がみられる。IgG1は接種後4日から検出され少なくとも40日間は持続する。一方、IgG2はワクチン接種後9日から検出され、35日後にピークとなる。しかし、個別のアイソタイプの力価や産生比率はワクチン製剤に用いるアジュバントの種類によって異なる。口蹄疫ウイルスの感染では、免疫グロブリンのアイソタイプのうち、少なくともIgG1とIgG2との間に抗原特異性や力価及び親和性などの点で差異はない。しかし、通常の不活化ワクチンでは、IgG1が、またペプチドワクチンではIgG2が、より効果的に誘導され、その免疫効果を比較するとIgG1が牛の免疫により有効と考えられている。ワクチンの種類や移行抗体の有無によっても異なるが、通常牛では、一回のワクチン接種で感染防御能は接種後21~28日でピークとなり、その効果は数カ月程度持続する。最近の報告では油性ワクチンによる牛と豚の免疫で、未だ中和抗体が検出されない接種後数日からすでに感染防御効果が認められている30,34,38)。
ワクチンによる粘膜局所の免疫の誘導をみると、牛では分泌型IgAの誘導はアジュバントの種類と接種頻度に依存し、通常の水性ワクチンを1~2回接種したのみでは、血清IgG1の局所への移行はみられても、分泌型IgAの産生能は誘導できない。豚では、油性ワクチン(油中水型または水中油中水型)で免疫すると接種後3~7日で鼻汁に中和抗体が検出される。しかし、追加免疫すると血清中和抗体価はその都度上昇するが、局所の中和抗体価は追加免疫に対しても大きく変動しない。豚における局所の感染防御能と血清中和抗体との関係は、牛におけるものほどには判明していない30)。
ワクチン接種後の細胞性免疫の誘導も主に牛で調べられている。末梢血リンパ球増殖反応はワクチンを数回以上接種した場合に認められ、口蹄疫ウイルス特異T細胞の免疫記憶は比較的長期間持続する。しかし、牛のT細胞の反応にはウイルスのタイプ間に交差反応がみられる。これはキャプシド蛋白質分子上のタイプ共通抗原決定基に依存する反応と考えられ、合成ペプチドを用いたT細胞抗原決定基の解析で明らかにされている。すなわち、種々の合成ペプチドで免疫した結果、牛のT細胞は主要キャプシド蛋白VP1のアミノ酸配列141~156番目と同じく200~213番目を認識し、前者の領域はタイプ特異反応がみられるのに対して、後者の領域はタイプ特異反応を示さない30)。一方、豚のT細胞の応答は牛のそれほどには調べられていない。Cタイプワクチンを接種した近交系豚において、ウイルス粒子や単離キャプシド蛋白質でタイプに非特異的なT細胞の免疫が誘導されたという報告があるに過ぎない。また、豚に2回ワクチン接種するとT細胞の免疫記憶は約1年間持続するが、T細胞増殖反応の誘導には牛の場合に比較してより多量の抗原が必要であるという30)。
ワクチンによる免疫の持続期間は、ワクチンの抗原量(146S含有量)、質(株固有の免疫原性の強弱)、及びアジュバントなど、ワクチン製剤ごとに異なる(表8)。一般に、免疫の持続という観点から見ると油性ワクチンが優れているが、水性(アルミゲル)ワクチンに比較して、その種類が多く持続期間は一様ではない。また、抗原量を増加させれば長い免疫持続期間が得られるというものではない。高い親和性を持つ抗体を得るためには高品質の抗原を至適量で免疫する必要があり、それにはアジュバントの種類や追加免疫の間隔が適切であることも重要な要素になる30)。
移行抗体の持続期間は動物種や母獣の免疫状況により大きく左右されるが、FlachselとHubikによると47)、ワクチン免疫した母豚から生まれた子豚の感染防御率は、生後1ヶ月、2ヶ月及び3ヶ月でそれぞれ90%、50%及び8%で、生後2~3ヶ月で急激に感染防御能が低下している。またAhlとWittmannは1)、子牛の移行抗体による感染防御能は生後4ヶ月で約10%と見積もっている。しかし、ワクチン免疫あるいは感染免疫のいずれによるものでも、移行抗体の存在はワクチンによる免疫賦与の障害になる63)。また、その障害の受け方は、ワクチン製剤ごとに異なっている30)。
3) ワクチン株の選択
口蹄疫が発生しワクチンを使用する必要が生じた場合は無論のことであるが、ワクチンを使用していない清浄国においても不測の事態を想定したワクチンの備蓄や、後述するワクチンバンクへの加盟といった対策がとられる。その際、野外株とワクチン株との抗原性状の関係がワクチンの効果にきわめて重要になる。このため、予測される流行株あるいは発生時の分離株の抗原性状が、ワクチン株との関係で前述したr1値をもとに解析される。実際の手法はワクチン製造会社により異なるが、現在口蹄疫WRLが世界の分離株について解析情報を提供している方法は概略以下の通りである46)。すなわち、最初に間接エライザ・サンドイッチ法で多数の抗ワクチン株モルモット血清に対する分離株の反応性を調べ、至適ワクチン株の絞り込みを行う。次いで液相競合エライザ・サンドイッチ法でワクチン株免疫牛血清(接種後21日)を用いて、前述のr1値を算出し最適ワクチン株を選択するというものである。この方法は、迅速で実験室内検査で実施できる簡便な方法であるが、単純にワクチン株と流行株との抗原相関度を示すものであって、ワクチン抗原の安定性、量、質、さらに宿主への免疫原性などで評価されるワクチン製剤の総合的な能力を示すものではない。
4) ワクチンの種類と応用
口蹄疫のワクチンは不活化ワクチンである。歴史的には一時弱毒株生ワクチンを検討した時期があった。しかし、このウイルスの性質上病原性の復帰という決定的な問題が避けられないことが判明したため、この試みは直ちに中止されている61)。不活化ワクチンにも歴史的に多種類の製法がある68)。しかし、現在ではBHK21細胞の浮遊細胞培養や回転培養で製造される組織培養ワクチンが主流となっている。大量培養したワクチン株ウイルスをエチレンイミンで不活化し8)、濃縮精製後アジュバントを加えて製品化する32)。通常牛用ワクチンのアジュバントには水酸化アルミニウムゲルが、また牛より免疫応答が鈍いとされる豚用には油性アジュバントが推奨されている。また、後述するワクチンバンク構想が具体化するようになって、動物種ごとの免疫研究の進展を踏まえて、抗原の不活化法、濃縮法、精製法、製品の安定性及びアジュバント製剤などの、いわゆるワクチン生産技術に関する開発研究や改良が加えられている32,33,34,114)。
新しいワクチンの試みとしては、合成ペプチドや組換え蛋白質を用いるペプチドワクチン、抗イディオタイプワクチン、ベクターウイルスを用いる生ワクチン、DNAワクチンなど様々な試みが行われている14,29,30,61,67,99)。また、不活化ワクチンにしても、より効果的に免疫を賦与するために新しいアジュバント剤やDDS(drug delivery system)の検討が行われている30)。しかし、こうした新しいワクチンでも、依然現行の不活化ワクチンを越えるものは得られていない。それは、口蹄疫ワクチンの有効性が、単にワクチンそのものによるものではなく、口蹄疫の疫学を基礎として、抗原解析、免疫応答、製造技術、そしてワクチン検定など極めて広範囲な総合科学技術を基盤にしているためである。
通常ワクチンを使用していない口蹄疫清浄国では、ワクチン接種動物のキャリアー化やウイルス抗原の変異などの問題があるため、本病の発生に対しては殺処分方式を基本とする防疫が行われる。しかし、こうした清浄国でも発生時に一時的に蔓延防止を目的とするワクチン接種が必要になる場合がある。一方、発生国や発生地域では全面的あるいは段階的に疾病防除を目的とするワクチン接種を実施している。前者は戦略ワクチンと呼ばれ36,61)、清浄国に発生した場合に発生地を中心に防疫帯を作り蔓延防止を図るために使用される。一方、後者は予防ワクチンと呼ばれ、発生国や発生地域で疾病予防に使用されている。また、従来戦略ワクチンの接種は主に牛を対象にしてきた。しかし、飼養密度が高く、個体のウイルス排出量も多いために、発生時の防疫上問題になる豚を優先的にワクチン接種の対象家畜にする必要性も生じている76,111)。戦略ワクチンのひとつとして、高度精製不活化抗原を液体窒素に凍結保存し、発生時に適切なアジュバントを加えて緊急に製品化する、いわゆるワクチンバンクが世界的に普及しつつある9,22,32,33,34,61,114)。最近では、アジュバント剤の改良と抗原量の調製により、接種後数日から発病阻止効果が現れるものがあり、迅速な効果を得るというバンクワクチンの目的から注目されている30,34,38)。現在稼働しているワクチンバンクには、国際バンク(イギリスを中心に島国や半島に位置する7カ国が対象)、欧州バンク(欧州連合域内国を対象に4カ所に分散設置)、北米バンク(カナダ、アメリカ及びメキシコ3国を対象)、ロシアバンク(ロシアとその他旧東欧圏を対象)の4種類がある。これらのワクチンバンクは、地域ごとに共通の防疫構想を持つ国で維持されているが、バンクに保存されている抗原量は発生地を中心にした蔓延防止に必要な程度に限られるので、全頭接種で防疫を行う可能性のあるハイリスク国は加盟出来ない場合も想定される。また、以上の他各国が個別にワクチン製造所と契約する商用バンクもある。
7. 防疫
1) 国際的な防疫体制
口蹄疫は国境を越えて蔓延し、発生国に社会・経済的規模の被害を及ぼす恐れのある伝染病である。そのため、現在国連FAOやOIEなどの国際機関が中心になって、口蹄疫の防疫活動が世界各地域で展開されている。とくに、OIEは、畜産物の国際流通における本病の重要性から、口蹄疫をはじめとする重要な家畜伝染病に関する国際衛生規則(国際家畜衛生コード)を定めている85)。国際協調と規制緩和を目標に発足した世界貿易機関(WTO)のSPS協定(衛生措置)が発効してからは、この規則は畜産物の国際流通に特別大きな意味を持つようになっている116,120)。この規則のうち口蹄疫に関しては、国や地域にあてはめられる口蹄疫清浄度区分とその基準、境界措置及び清浄化への条件などが詳細に規定されており、その規定に従って畜産物の貿易が行われる。万一、清浄国で口蹄疫が発生した際にも、再び清浄国に復帰するまでには、ワクチン接種や殺処分方式の有無、ワクチン接種動物の淘汰、広域サーベイランス体制の実施など、採用した防疫手法によって異なる条件を守る義務が加盟国に課せられている。また、各国は発生時の防疫の理論と実践及び問題点を検討し、独自の防疫マニュアルを準備している5,52,92,93,94)。
2) 日本の防疫
わが国はOIEの口蹄疫清浄度区分でも最も高い清浄度に位置付けられている。このため、国際家畜衛生規則による輸入相手国の口蹄疫清浄度に応じて、農畜産物に輸入禁止、条件輸入などの制限措置を講じ、その清浄度を維持している。また、同時に関連法規に基づいて厳重な検疫体制が敷かれている。しかし、万一わが国で口蹄疫が発生した場合には、「家畜伝染病予防法」(法律第166号、昭和26年5月31日)並びに「海外悪性伝染病防疫要領」などの関連法規に基づき、移動制限と殺処分方式を基本とする防疫措置がとられる。病性決定までの措置や決定後の措置などもこの防疫要領に定められている。
それによると、患畜及び疑似患畜はすべて殺処分と埋却あるいは焼却する。疑似患畜には、患畜と同居する感受性動物の全てと、口蹄疫の伝播において発生農場と関係のある飼養施設の感受性動物全てが対象になる。口蹄疫の伝播はきわめて早いので、発生した場合に最も重要なことは、可能な限り早期に発見して、発生農場の家畜を移動禁止とし、病性が決定したら早急に殺処分して、蔓延防止を図る。汚染飼料、畜舎及び汚染の可能性のある全ての器具、資材も消毒または焼却する。発生時に防疫資材として使用する消毒液には、安価で大量に調達できる確実な消毒液が望ましく、2%苛性ソーダや4%炭酸ソーダ(いずれも工業用で可)などが適している。一方、蔓延防止のために発生地を中心にした段階的な移動制限措置がとられる。患畜と疑似患畜の所在する発生地では、48時間を越えない範囲で通行遮断が実施できることになっている。また、発生地から半径20Km以内を汚染地とし、最終発生例の措置後3週間までの範囲で牛や豚など感受性家畜の移動を禁止、家畜市場や食肉センター等を閉鎖する。さらに、発生地から半径50Km以内を警戒地域とし、初発後3週間以内の範囲で牛、豚、緬山羊などの感受性家畜の域外への移動を禁止する。こうした蔓延防止措置はきわめて重要かつ有効であるが、その実施に当たっては綿密な追跡調査の結果に基づいて実施される必要がある。
ワクチンの使用は国が必要と判断した場合にのみ指示によって使用することができる。このため、わが国では不測の事態に備えて近年の流行株の抗原性状を勘案してワクチンが備蓄されている。しかし、上述したように口蹄疫ワクチンは不活化ワクチンで、その効果は、例えば豚では豚コレラワクチンの様に優れたものではない。また、ワクチン製造に用いているウイルスの抗原性が、流行株と同一である確率は理論的には低く、著しく異なる場合には効果がないか、あっても弱いので感染を阻止できないという問題や、ワクチンによる免疫成立までに日数を要するなどの問題がある。さらに前述したように、免疫持続期間が比較的短いこと、幼獣の免疫応答が弱いこと、ワクチン接種後の抗原変異や移行抗体の問題など多くの問題もある。また、ワクチン接種しない清浄国の地位を保つことが、畜産物の国際競争力を維持できるという経済的な理由もある61)。このため、ほとんどの先進国では、口蹄疫の発生があった場合にも迅速な殺処分を防疫の柱とし、ワクチンの使用は、発生が多く殺処分のみでは防疫が間に合わない場合に一時的に地域を限定して蔓延を防止する、いわゆる周辺ワクチネーション(戦略ワクチン)を実施することにしている5,36,87,94)。この方法は、清浄国に復帰するまでの期間を短縮し、その経過を容易にするためでもある。さらに、ワクチンを接種した動物は、ウイルスの感染を隠すため、接種動物は移動を禁止して発生が終息した時点で淘汰する方法がとられる85)。このため、防疫のためであってもワクチンを使用した際には、OIEは清浄国への復帰条件として病原並びに血清学的な全国調査を義務付けている85)。こうした事態に備えてすでに家畜の個体識別制度を導入した国や地域もある36)。このように、清浄国で発生時の緊急防疫のために使用するワクチンは、OIEが国際衛生規則で定めている清浄国への復帰条件を見据えて使用されるべきものである。
おわりに
口蹄疫には、伝染力が強い、宿主域が広い、早期発見が難しい、及び、ワクチン効果に限界があるなどの防疫上の基本的な問題があり、世界の畜産業にとって、輸出国、輸入国のいずれの立場でも、最も重要な家畜伝染病に位置付けられている。このため、農産物の流通を著しく制約する口蹄疫に対しては、汚染地域では周辺国との協力で広域の清浄化計画が進行中であるとともに、清浄地域では周辺国あるいは経済圏単位で共通の防疫対策がとられている。一方、わが国は世界でも最大級の畜産物輸入国であると同時に、国際的には依然相当数の飼養家畜を有する畜産国でもある。こうした状況下で、口蹄疫が侵入、蔓延して防疫に手間取るような最悪の事態を想定すれば、国内畜産業は多大の直接的な経済被害を受けるばかりでなく、現在制限されている地域の畜産物との内外価格差を考慮すると、わが国の畜産業全体が極めて厳しい立場におかれる恐れがある。ワクチンを使用しない完全な口蹄疫清浄国の立場を保つことが、国内畜産業の安定の前提になっている。従って、万一本病が発生した場合にも、被害を最小限にとどめ常在化させることのないよう、口蹄疫の病性を理解し迅速、的確な対応をとる必要がある。
引用文献
- Ahl, R. and Wittmann, G. 1987. Protection of young animals against foot-and-mouth disease. Res. Group Eur. Comm. Contr. FMD, Lyons, France, pp.11-13.
- Amaral-Doel, C.M.F. et al. 1993. Detection of foot-and-mouth disease viral sequences in clinical specimens and ethyeleneimine-inactivated preparations by the polymerase chain reaction. Vaccine, 11: 415-421.
- Anderson, E.C., Doughty, W.J. and Anderson J. 1974. The effect of repeated vaccination in an enzootic foot-and-mouth disease area on the incidence of virus carrier cattle. J. Hyg. (Camb.), 73: 229-235.
- Anderson, E.C. et al. 1993. The role of wild animals, other than buffalo, in the current epidemiology of foot-and-mouth disease in Zimbabwe. Epidemiol. Infect., 111: 559-563.
- Animal and Plant Health Inspection Service, 1991. Foot-and-mouth disease emergency disease guidlines, U.S.Dept. of Agricult.
- Astudillo, V. et al. 1997. Risks of introducing foot and mouth disease through the importation of beef from South America. Rev. sci. tech. Off. int. Epiz., 16: 33-44.
- Bachrach, H.L. et al. 1975. Immune and antibody responses to an isolated capsid protein of foot-and-mouth disease virus. J. Immunol. 115: 1635-1641.
- Bahnemann, H.G. 1975. Binary ethylenimine as an inactivant for foot-and-mouth disease virus and its application for vaccine production. Arch. Virol. 47: 47-56.
- Barteling, S.J. et al. 1990. A FMD vaccine bank: purified inactivated antigen stored at ultra-low temperatures for the rapid preparation of double oil emulsion vaccines. Res. Group Eur. Comm. Contr. FMD, Lindholm, pp.172-177.
- Beck, E. and Strohmaier, K. 1987. Subtyping of European foot-and-mouth disease virus strains by nucleotide sequence determination. J. Virol., 61:1621-1629.
- Bendall, J.R. 1977. Variability in rates of pH fall and of lactate production in the muscles on cooling beef carcasses. Meat Sci., 2: 91-104.
- Bengis, R.J., Thomson, G. R. and De Vos, V. 1087. Foot-and-mouth disease and the African buffalo: a review. J. S. Afr. Vet. Assoc. 58:160-162.
- Bergmann, I.E. et al. 1993. Diagnosis of persistent aphthovirus infection and its differentiation from vaccination response in cattle by use of enzyme-linked immunoelectrotransfer blot analysis with bioengineered nonstructural viral antigens. Am. J. Vet. Res., 54: 825-831.
- Bittle, J. et al., 1982. Protection against foot-and-mouth disease by immunization with a chemically synthesized peptide produced from viral nucleotide sequence. Nature, 298:30.
- Blackwell, J.H. 1976. Survival of foot-nand-mouth disease virus in cheese. J. Dairy Sci., 59: 1574-1579.
- Blackwell, J.H. et al. 1982. Effect of thermal processing on the survival of foot-and-mouth disease virus in ground meat. J. Food Sci., 47: 388-392
- Brown, C. C., Olander, H.J. and Meyer, R.F. 1989. Pathogenesis of foot-and-mouth disease in guinea pigs using in situ hybridization. Proc 93rd Annu. Meeting US Anim Health Assoc., pp.321-323.
- Burrows, R. 1966. Studies on the carrier state of cattle exposed to foot-and-mouth disease virus. J. Hyg. (Camb.) 64: 81-90.
- Burrows, R. et al. 1968. Excretion of foot-andmouth disease virus prior to the development of lesions. Vet. Rec., 82:387-388.
- Burrows, R. 1971. The growth and persistance of foot-and-mouth disease virus in the bovine mammary gland. J. Hyg (Camb.) 69: 307-321.
- Burrows R. et al. 1981. The pathogenesis of natural and stimulated natural foot-and-mouth disease infection in cattle. J. comp. Pathol., 91: 599-609.
- Callis, J. 1994. Vaccine banks: present status and future development. p7-11. 62nd General Session of OIE, Paris.
- Cottral, G.E., Gailiunas, P. and Cox, B.F. 1968. Foot-and-mouth disease virus in semen of bulls and its transmission by artificial insemination. Arch. gesamte Virusforsch., 23: 362-377.
- Cottal, G.E. 1969. Persistence of foot-and-mouth disease virus in animals, their products and environment. Bull. Off. int. Epizoot., 71: 549-568.
- Cunliffe, H. R. et al. 1979. Inactivation of milk-borne foot-and-mouthdisease virus at ultrahigh temperatures. J. Food. Prot., 23:135-137.
- Danish Veterinary Service. 1982. The eradication of foot-and-mouth disease on the islands of Funen and Zealand, Denmark 1982. Report. The Danish Veterinary Service, Copenhagen, 61-62.
- Dawe, P.S. et al. 1994. Experimental transmission of foot-and-mouth disease virus from carrier African Buffalo (Syncerus caffer) to cattle in Zimbabwe. Vet. Rec., 134: 211-215.
- DeMello, P.A. et al. 1986. RNA fingerprinting of South American prototype aphthovirus strains. Vaccine 4:105-110.
- DiMarchi, R. et al. 1986. Protection of cattle against foot-and-mouth disease by a synthetic peptide. Science, 232: 639-641.
- Doel,T.R. 1996. Natural and vaccine-induced immunity to foot-and-mouth disease: the prospects for improved vaccines. O. I. E. Bull. 15(3):883-911
- Doel, T.R. and Collen, T. 1980. Qualitative assessment of 146S particles of FMDV in preparations destined for vaccines. J. Biol. Stand., 10: 69-81.
- Doel, T.R. and Deborah, J.D. 1984. The stability and potency of vaccines prepared from inactivated foot-and-mouth disease virus concentrates. J. Biol. Standard., 12: 247-255.
- Doel, T.R. and Pullen, L. 1990. International bank for foot-and-mouth disease vaccine: stability studies with virus concentrates and vaccines prepared from them. Vaccine, 8: 473-478.
- Doel, T.R., Williams, L. and Barnett, P.V. 1994. Emergency vaccination against foot-and-mouth disease: rate of development of immunity and its implications for the carrier state. Vaccine, 12: 592-600.
- Donaldson, A.I. 1997. Risks of spreading foot and mouth disease thrugh milk and dairy products. Rev. sci. tech. Off. int. Epiz., 16: 117-124.
- Donaldson,A.I. and Doel,T.R. 1992. Foot-and-mouth disease: the risk for Great Britain. Vet. Rec. 131:114-120
- Donaldson A.I. and Ferris, N.P. 1980. Sites of release of airborne foot-and-mouth disease virus from infected pigs. Res. Vet. Sci., 29: 315-319.
- Donaldson, A.I. and Kitching, R.P. 1989. Transmission of foot-and-mouth disease by vaccinated cattle following naural challenge. Rev. vet. Sci., 46: 9-14.
- Donaldson, A.I. et al. 1970. Further investigations on the airborne excretion of foot-and-mouth disease virus. J. Hyg. (Camb.), 68: 557-564.
- Donaldson, A.I. et al. 1987. Infection of cattle by airborne foot-and-mouth disease virus: minimal doses with O1 and SAT2 strains. Res. Vet. Sci., 43: 339-346.
- Donaldson, A. I. et al. 1996. Foot-and-mouth disease. OIE Manual of standards for diagnostic tests and vaccines, 3rd ed., OIE, Paris, France
- Dunn, C. S. and Dnaldson, A. I. 1997. Natural adaption to pigs of a Taiwanese isolate of foot-and-mouth disease virus. Vet. Rec. 141: 174-175.
- Farez, S. and Morley R. S. 1997. Potential animal health hazards of pork and pork products. Rev. sci. tech. Off. int. Epiz., 16: 65-78.
- Fellowes, O.N. 1960. Chemical inactivation of foot and mouth disease virus. Ann. N.Y. Acad. Sci., 83: 595-608.
- Ferris, N.P. and Dawson, M. 1988. Routine application of enzyme-linked immunosorbent assay in comparison with complement fixation for the diagnosis of foot-nad-mouth disease and swine vesicular disease. Vet. Microbiol., 16: 201-209.
- Ferris, N.P. and Donaldson, A.I. 1992. The World reference laboratory for foot-and-mouth disease: a review of thirty-three years of activity (1958-1991). Rev. sci. tech. Off. int. Epiz., 11: 657-684.
- Flachsel, P. and Babiuk, R. 1987. The influence of colostral immunity against types A, O and C FMD on the responce of Pigs to vaccination. Res. Group Eur. Comm. Contr. FMD, Lyons, France, pp.44-58.
- Gainoru, M. D.et al. 1986. Foot-and-mouth disease and the African buffalo (Syncersus caffer). II. Virus excretion and transmission during acute infection. Ondersteport J. Vet. Res., 53: 75-85.
- Garland, A.J.M. et al. 1981. The 1975 foot-and-mouth disease epidemic in Malta. II: The detection of carriers and inapparent infection. Brit. vet. J., 137: 381-387.
- Gebauer, F. et al. 1988. Rapid selection of genetic and antigenic variants of foot-and-mouth disease virus during persistance in cattle. J. Virol., 62: 2041-2049.
- Gloster,J. 1982. Risk of airborne spread of foot-and-mouth disease from the Continent to England. Vet. Rec., 111: 290-295.
- Gowers, E. 1968. Report of the departmental committee on foot-and-mouth disease, 1952-1954. 口蹄疫防疫の理論と実践(英国における口蹄疫防疫の反省)、農林省畜産局衛生課訳、農林省畜産局刊行、東京
- Hamblin, C., Barnett, I.T.R. and Hedger, R.S. 1986. A new enzyme-linked immunosorbent assay (ELISA) for detection of antibodies against foot-and-mouth disease virus. I. Development and method of ELISA. J. Immunol. Method., 93: 115-121.
- Hamblin, C., Barnett, I.T.R. and Crowther, J.R. 1986. A new enzyme-linked immunosorbent assay (ELISA) for detection of antibodies against foot-and-mouth disease virus. II. Application. J. Immunol. Method., 93: 123-129.
- Hamblin, C. et al. 1987. Enzyme-linked immunosorbent assay (ELISA) for detection of antibodies against foot-and-mouth disease virus. III. Evaluation of antibodies after infection and vaccination. Epidemiol. Infect., 99: 733-744.
- Henderson W.M. and Brooksby, J.B. 1948. The survival of foot and mouth disease virus in meat and offal. J. Hyg., 46: 394-402.
- House, C. and House, J.A. 1989. Evaluation of techniques to demonstrate foot-and-mouth disease virus in bovine tongue epithelium: comparison of the sensitivity of cattle, mice, primary cell cultures, cryopreserved cell cultures, and established cell lines. Vet. Microbiol., 20: 99-109.
- House, J. A. and House, C. A.(1992). Vesicular diseases. p387-398, Disease of swine 7th ed., Leman et al., Wolfe Publishing Ltd., England
- Hugh-Jones, M.E. and Wright, P.B. 1970. Studies on the 1967-8 foot-and-mouth disease epidemic. The relation of weather to the spread of disease. J. Hyg. (Camb.) 68: 253-271.
- Hurst, G.W. 1968. Foot-and-mouth disease; the possibility of continental sources of the virus in England in epidemics of October 1967 and several other years. Vet. Rec. 82: 610-614.
- Kitching, R.P. 1992. The application of biotechnology to the control of foot-and-mouth disease virus. Brit. vet. J., 148: 375-388.
- Kitching, R. P. and Ferris,N.P.(1996). Review of the foot-and-mouth disease situation in the world, 1995: Epidemiological situation. FMD Newsletter 1(4):1-4
- Kitching, R.P. and Salt, J.S. 1995. The interference by maternally-derived antibody with active immunization of farm animals against foot-and-mouth disease. Brit. vet. J., 151: 379-389.
- Kitching, R. P. et al. (1988). Rapid correlation between field isolates and vaccine strains of foot-and-mouth disease virus. Vaccine, 6:403-408
- Kitching, R.P. et al. 1989. Development of foot-and-mouth disease virus strain characterisation- a review. Trop. Anim. Hlth Prod., 21: 153-166.
- Kitson, J.D., McCahon, D. and Belsham, G.J. 1990. Sequence analysis of monoclonal antibody resistant mutants of type O foot-and-mouth disease virus: evidence for the involuvement of the three surface exposed capsid porteins in four antigenic sites. Virology, 179: 26-34.
- Kleid, D.G. et al. 1981. Cloned viral protein vaccine for foot-and-mouth disease: responses in cattle and swine. Science, 214: 1125-1129.
- 熊谷哲夫 1989. ピコルナウイルス科 5.アフトウイルス属. p689-696, 新編獣医微生物学, 梁川ほか 編, 養賢堂, 東京
- 熊谷哲夫 1970. 技術講座(17)「注目すべき海外伝染病」家畜衛生週報、No.1121 p375-382.
- Laor, O. et al. 1992. Detection of FMDV RNA amplified by the polymerase chain reaction (PCR). J. Virol. Method., 36: 197-208.
- Lasta, J. et al. 1992. Combined treatments of heat, irradiation, and pH effects on infectivity of foot-and-mouth disease virus in bovine tissues. J. Food Sci., 57: 36-39.
- MacDiarmid, S.C. and Thompson, E.J. 1997. The potential risks to animal health from imported sheep and goat meat. Rev. sci. tech. Off. int. Epiz., 16: 45-56.
- McVicar, J.W. and Sutmoller, P. 1970. Foot-and-mouth disease: the agar gel immunodiffusion precipitin test for antibody to virus-infection-associated (VIA) antigen as a tool for epizootiologic surveys Am. J. Epidemiol., 92: 273-278.
- McVicar, J.W. et al. 1978. Foot-and-mouth disease and swine vesicular disease viruses in boar semen. Proc. 81st Annu. Meet. US Anim. Health Assoc., pp.221-230.
- Malirat, V. et al. 1994. Genetic variation of foot-and-mouth disease virus during persistant infection in cattle. Virus Res., 34: 31-48.
- Maragon,S.et al. 1994. The 1993 Italian foot-and-mouth disease epidemic:epidemiological features of the four outbreaks identified in Verona province(Veneto region).Vet.Rec.135:53-57
- Marquardt, O. and Adam, K. 1990. Foot-and-mouth disease virus subtyping by sequencing VP1 genes. Vet. Microbiol., 23: 175-183.
- Masara,M.O. et al. 1995. Effect of low-temperature long-time thermal processing of beef-cuts on the survival of foot-and-mouth disease virus. J. Food Protect. 58:165-169
- Mason, P.W., Rieder, E. and Baxt, B. 1994. RGD sequence of foot-and-mouth disease virus is essential for infecting cell via the natural receptor but can be bypassed by an antibodiy-dependent enhancement pathway. Proc. Natl. Acad. Sci. USA., 91: 1932-1936.
- Mebus, C.A. and Singh, E.L. 1991. Embryo transfer as a means of controlling the transmission of viral infecions. XIII. Failure to transmit foot-and-mouth disease through the transfer of embryos from viremic donors. Theriogenology, 35: 435-441.
- Mebus, C. A. et al. 1993. Survival of foot-and-mouth disease, African swine fever, and hog cholera viruses in spanish serrano cured hams and Iberian cured hams, shoulders and loins. Food Microbiol. 10:133-143
- Meyer, R.F. et al. 1991. Rapid and sensitive detection of foot-and-mouth disease virus in tissues by enzymatic RNA amplification of the polymerase gene. J. Virol. Method., 34: 161-172.
- Moutou, F. and Durand, B. 1994. Modelling the spread of foot-and-mouth disease virus. Vet. Res., 25: 279-285.
- Neitzert, E. et al. 1991. Expression of the aphthovirus RNA polymerase gene in Eschrichia coli and its use together bioengineered nonstructural antigens in detection of late persistent infections. Virology, 184: 799-804.
- Office International des Epizooties, 1996. International animal health code, mammals, birds and bees. updates 1993-1996, p57-70
- Official data. 1965. 口蹄疫.技術の手引き4.農林省監修.日本獣医師会、東京
- Official data. 1994. Foot-and-mouth disease: sources of outbreaks and hazard categorization of modes of virus transmission. Center for epidemiology and animal health, 1994. USDA, APHIS and VS. Colorado, USA.
- Pinina, G.F. et al. 1989. Survival of foot-and-mouth disease virus in sousage meat products (Italian salami). Int. J. Food Microbiol., 8: 141-148.
- Pinto A.A. and Garland, A.J.M. 1979. Immune response to virus-infection-associated (VIA) antigen in cattle repeatedly vaccinated with foot-and-mouth disease virus inactivated by formalin or acetylethyleneimine. J. Hyg. (Camb.), 82: 41-50.
- Rahman, H., Dutta, P.K. and Dewan, J.N. 1988. Foot-and-mouth disease in elephant (Elephas maximus). J. Vet. Med., 35: 70-71.
- Rapoport, E. and Shimshony, A. 1997. Health hazard to the small ruminant population of the Middle East posed by the trade of sheep and goat meat. Rev. sci. tech. Off. int. Epiz., 16: 57-64.
- Report of the Committee of Inquiry on foot-and-mouth disease. Part 1. 1968. 英国口蹄疫調査委員会報告、1969. 英国における口蹄疫防疫、第1部、農林省畜産局衛生課訳、農林弘済会刊行、東京
- Report of the Committee of Inquiry on foot-and-mouth disease. Part 2. 1969. 英国口蹄疫調査委員会報告、1970. 英国における口蹄疫防疫、第2部、農林省畜産局衛生課訳、農林弘済会刊行、東京
- Report of the session of Res. Group Eur. Comm. Contr. FMD, 1991. Recomendations for contingency plans including actions in non-vaccinating countries. Working document. pp.10-27, Ankara, Turkey.
- Report of the session of Res. Group Eur. Comm. Contr. FMD, 1992. Persistance of FMD virus in ruminants including game animals. pp.2-3, Mittelhausen, Switzerland.
- Rodriguez, A. et al. 1992. Primer design for specific diagnosis by PCR of highly variable RNA viruses: typing of foot-and-mouth disease virus. Virology, 189: 363-367.
- Rodriguez, A. et al. 1994. Direct PCR detection of foot-and-mouth disease virus. J. Virol. Method., 47: 345-349.
- Roeder, P.L. and LeBlanc Smith, P.M. 1987. Detection and typing of foot-and-mouth disease virus by enzyme-linked immunosorbent assay: a sensitive, rapid, and reliable technique for primary diagnosis. Res. Vet. Sci., 43: 225-232.
- Roosien, J. et al. 1990. Synthesis of foot-and-mouth disease virus capsid proteins in insect cells using baculovirus expression vectors. J. gen. Virol., 71: 1703-1711.
- Rueckert,R.R.(1990): Picornaviridae and their replication. p507-548, Virology, B.N.Fields et al., 2nd ed., Raven Press, New York
- Saiz, J.C., Sobrino, F. and Dopazo, J. 1993. Molecular epidemiology of foot-and-mouth disease virus type O. J gen. Virol., 74: 2281-2285.
- Salt, J.S. 1993. The carrier state in foot-and-mouth disease- an immunological review. Brit. Vet. J., 149: 207-223.
- Sellers, R.F. 1968. The inactivation of foot-and-mouth disease virus by chemicals and disinfectants. Vet. Rec. 83: 595-608.
- Sellers, R.F. 1971. Quantitative aspects of the spread of foot and mouth disease. Vet. Bull., 41: 431-439.
- Sellers, R.F. and Parker, J. 1969. Airborne excretion of foot-and-mouth disease virus. J. Hyg. (Camb.), 67: 671-677.
- Sellers, R.F., Herniman, K.A. and Dnaldson, A.I. 1971. The effects of killing or removal of animals affected with foot-and-mouth disease on the amounts of airborne virus present in loose boxes. Brit. Vet. J., 127: 358-365.
- Snowdon, W.A. 1966. Growth of foot-and-mouth disease virus in monolayer cultures of calf thyroid cells. Nature, 210: 1079-1080.
- Straver, P.J. et al. 1970. Some properties of carrier strains of foot-and-mouth disease virus. Arch. gesamte Virusforsch., 29: 113-126.
- Sutmoller, P. and McVicar, J.W. 1976. Pathogenesis of foot-and-mouth disease; the lung as an additional portal of entry of the virus. J. Hyg. (Camb.), 77: 235-243.
- Sutmoller, P. and Vose, D.J. 1997. Contamination of animal products: the minimum pathogen dose required to initial infection. Rev. sci. tech. Off. int. Epiz., 16: 30-32.
- Swam, H. et al. 1994. New strategies for control of foot-and-mouth disease (FMD) outbreaks in unvaccinated Europe: Use of a highly potent vaccine on pig farms as an alternative to "stamping out". Res. Group Eur. Comm. Contr. FMD, Vienna, Austria, pp.85-87.
- 武田直和(1992): ピコルナウイルスのゲノム構造と 機能.蛋白質核酸酵素 37(14) :2408-2413
- Terpstra, C. 1972. Pathogenesis of foot-and-mouth disease in experimentally infected pigs. Bull. Off. int. Epizoot., 77: 859-874.
- Terpstra,C., Dekker, A. and van Maanen,C. 1994. Shelf life of FMD-double oil emulsion vaccines prepared from stored antigen. Res. Group Eur. Comm. Contr. FMD, Vienna, Austria, pp.80-83.
- Thalmann, G. 1989. Foot-and-mouth disease (FMD). Appl. Vet. Epidemiol., pp.17-26, Blaha,T. ed., Developments in Animal and Veterinary Sciences Vol 21., Elsevier, Amsterdam, Oxford, Newyork, Tokyo.
- Thiermann, A.B. 1997. The relationship between the World Trade Organisation and the Office International des Epizooties. Rev. sci. tech. Off. int. Epiz., 16: 13-16
- Thomson, G. R.(1996). The role of carrier animals in the transmission of foot-and-mouth disease. Report in O.I.E. 64th general session, p1-18
- 徳井忠史 (1987). 口蹄疫、p283-295、豚病学 第3版、近代出版、東京
- Van Bekkum, J.G. et al. 1959. Observation on the carrier state of cattle exposed to foot-and-mouth disease virus. Tijdschrift voor Dieregeneeskunde, 84: 1159-1164.
- Vose, D.J. 1997. Risk analysis in relation to the importation and exportation of animal products. Rev. sci. tech. Off. int. Epiz., 16: 17-29.
- Westbury, H.A. et al. 1988. A comparison of enzyme-linked immunosorbent assay, complement fixation, and virus isolation for foot-and-mouth disease diagnosis. Vet. Microbiol., 17: 21-28.
- Wilson, W.W. and Matheson, R.C. 1952. Bird migration and foot-and-mouth disease. Vet. Rec., 64: 541-548.