動物衛生研究部門
掲載日:2012年5月10日、2013年1月17日更新
動物衛生研究所のアルボウイルス感染症に対する取り組みと、ヨーロッパ北部におけるシュマレンベルクウイルス(Schmallenberg virus)感染症の発生概要 (2013年1月)
はじめに
アルボウイルス(Arthropod-borne virus:節足動物媒介ウイルス)とは蚊やダニなどの吸血性節足動物によって媒介され、ヒトや家畜などの脊椎動物に感染するという生態学的特徴を持つウイルスの総称で、様々な科や属に分類されるウイルスがこれに含まれる。アルボウイルスによる家畜の病気として、トガウイルス科やフラビウイルス科に属するウイルスによる牛や豚等の脳炎や流死産、ブニャウイルス科やレオウイルス科、ラブドウイルス科に属するウイルスによる牛やめん山羊等の熱性疾患等が知られているが、未だ病気との関連が不明なウイルスも数多く存在する。めん羊の代表的な病気として知られるブルータングはレオウイルス科オルビウイルス属のウイルスによって起こる伝染病であり、牛やめん山羊で流産、早産、死産および先天異常を起こすアカバネ病やアイノウイルス感染症はブニャウイルス科オルソブニャウイルス属のウイルスによって起こる。
日本では、1972~1975年に牛の流産、早産、死産や先天異常子の出産を主徴とする、いわゆる「異常産」が北海道を除く全国で流行し、その後これがアカバネウイルスによることが判明したことから、アカバネ病と名付けられた。日本におけるアカバネ病の流行はこの発生以前にも起こっていたと考えられており、1978年にアカバネ病ワクチンが用いられるようになってからも、西日本を中心に5~10年周期でアカバネ病の大きな発生が起こっている。また、西日本では同じオルソブニャウイルス属のアイノウイルスによる牛の異常産も発生している。アカバネウイルスやアイノウイルスは、ハエ目に属する体長1~3mm程の微小な吸血昆虫“ヌカカ”によって媒介される。日本ではこれらのウイルスは、主にウシヌカカ(Culicoides oxystoma)から分離されていることから、このヌカカが日本での主要な媒介種であると考えられる。ヌカカは気温の高い時期に吸血を行うことから、日本でのウイルスの伝播は夏から秋にかけて西日本を中心に起こる。また、一度感染した動物は免疫を獲得し、抗体を持った後はウイルスに感染しないことから、日本における周期性を持った発生は、動物の世代交代が進み免疫を持たない動物の割合が増えたときに起こると理解されている。しかし、近年の気候変動によって流行周期が早くなったり、流行地域が北上したりする傾向が見られていることから、アカバネ病等のアルボウイルス感染症の流行監視の重要性はますます高まっている。
1.動物衛生研究所のアルボウイルス感染症に対する取り組みと、国内におけるアルボウイルスの監視体制
動物衛生研究所は都道府県の家畜保健衛生所や家畜衛生試験場と協力して、おとり牛や媒介節足動物からのウイルス分離や分離ウイルスの性状解析を行い、アルボウイルスの国内への侵入および浸潤状況について監視を行ってきた1,2)。現在まで、牛の異常産の原因となるアカバネウイルス、アイノウイルスおよびチュウザンウイルス、あるいは牛に熱性疾患を起こすイバラキウイルスや牛流行熱ウイルスの国内への侵入が相次いで確認されている。これらのウイルスに対してはワクチンが開発されており、接種率の向上とともに大きな病気の発生は見られなくなった。しかし、最近では新規のアルボウイルスが、九州や沖縄で分離される例が相次いでいる。特に、2000年頃からはアカバネウイルスやアイノウイルス以外にオルソブニャウイルス属のピートンウイルス(1999年)、サシュペリウイルス(1999年)およびシャモンダウイルス(2002年)などが相次いで牛やヌカカから分離され、こうした新たなウイルスがわが国にも侵入していることが明らかになった。これらの新規アルボウイルスと家畜の疾病との関係は不明であるが、ピートンウイルスのように異常産との関連が強く疑われている例もある3)。これらのウイルスは多くの場合ヌカカによって媒介されると考えられており、ヌカカの生態やウイルス媒介能についての研究も進行中である。また、ウイルスの性状解析の過程で得られた情報を基に、血清学的および遺伝学的診断系の開発にも努めている4,5)。
2.シュマレンベルクウイルス感染症の発生概要
1)現在までの経過
2011年、夏、ドイツ中西部のノルトライン=ヴェストファーレン州で、乳牛が40度以上の高熱を発し、食欲不振や下痢、乳量の低下を呈する症例の多発が報告された。ドイツ連邦のフリードリヒ・レフラー研究所は、同年11月、牛の血液から抽出されたRNAを用いたメタゲノム解析により、これまで知られていないウイルスの遺伝子を検出した6)。検出された遺伝子は、ブニャウイルス科オルソブニャウイルス属、特にアカバネウイルスやアイノウイルスを含むシンブ血清群のウイルスと高い相同性を持っていた。後に、症状を示した牛からウイルスも分離され、最初に検出された地名をもとにシュマレンベルクウイルス(Schmallenberg virus)と暫定的に呼称されている。同様の症状は、オランダの乳牛でもみられ、PCRによってシュマレンベルクウイルスの遺伝子が検出されている7)。2011年秋からは、シュマレンベルクウイルスの感染が疑われる四肢や脊柱の湾曲などの体形異常や、大脳欠損などを示す先天異常子の出産(異常産)が相次いでめん羊で報告されている8)。同じような体形異常を示す先天異常子の出産は、牛や山羊、バイソンでも確認されている9)。このように、反芻動物に先天異常を起こす症状は、アジアやオセアニアで流行しているアカバネ病、アイノウイルス感染症に極めて類似している。2012年の春までに、シュマレンベルクウイルス感染症の流行はドイツ、オランダ、ベルギー、ルクセンブルク、イギリス、フランス、イタリア、スペインに拡大しており、畜産業界のみならず社会的に大きなインパクトを与えた10)。また、2012年の7月から10月にかけて、イギリスおよびフランスの一部の地域やスイスにおいて、成牛での発熱や泌乳量の減少などの急性症例が報告され、シュマレンベルクウイルスがヨーロッパで越冬したことが示された11,12)。前述の国々に加えて、デンマーク、スウェーデン、ノルウェイ、フィンランド、ポーランド、アイルランド、オーストリアにシュマレンベルクウイルスの感染は拡大し、2012年10月までに5,955件の農家で同ウイルスによる異常産が確認されている。現在、日本を含む感染が確認されていない国々では、発生国からの生きた家畜およびその受精卵、精液の輸入の際に抗体検査や遺伝子検出などを義務化している場合が多い13)。
2)病因
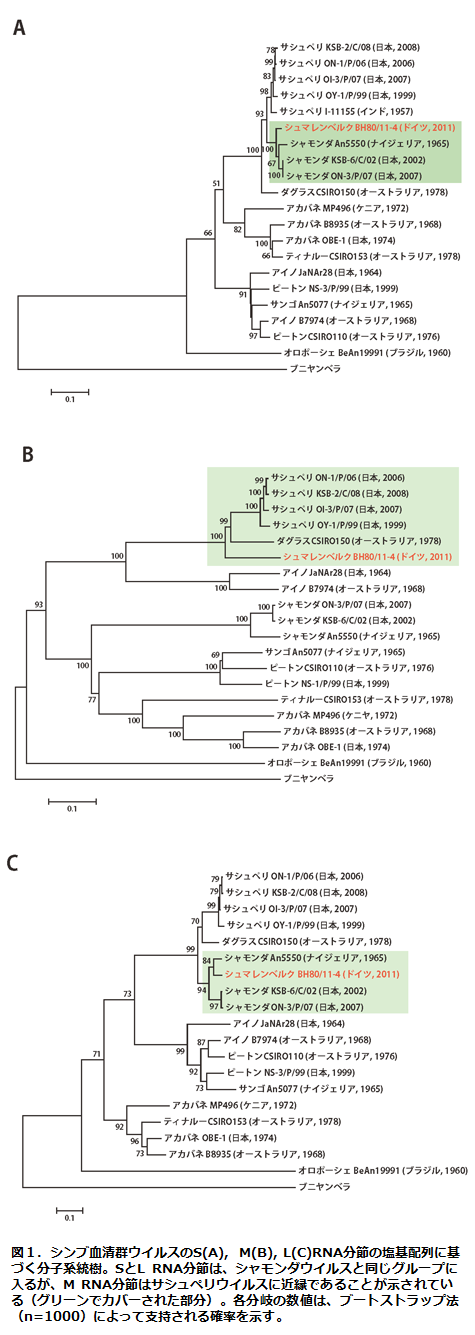
シュマレンベルクウイルスは、ブニャウイルス科オルソブニャウイルス属に分類される。オルソブニャウイルス属のウイルスは、S,MおよびL の三本のマイナス鎖RNA分節ゲノムを持ち、蚊やヌカカによって媒介されるアルボウイルスである。S,MおよびL RNA分節は、それぞれ、ヌクレオカプシド、外被糖タンパク質およびRNAポリメラーゼをコードしている14)。2012年1月にはシュマレンベルクウイルスの全塩基配列が公開され、アカバネやアイノウイルスを含むシンブ血清群のウイルスと近縁であることが明らかになった6)。この報告では、シュマレンベルクウイルスはS RNA分節の塩基配列の比較により、シャモンダウイルスの日本分離株と遺伝学的に非常に近いとされた。
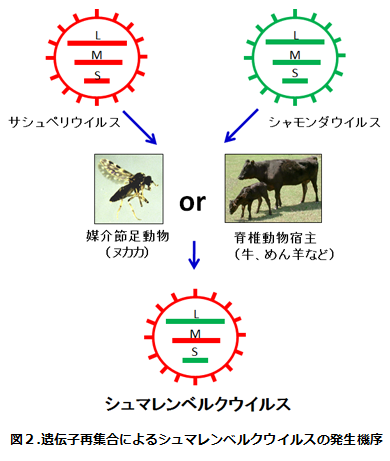
しかし、動物衛生研究所でこれまで蓄積した国内分離株を中心としたアルボウイルスの遺伝子データと比較すると、シュマレンベルクウイルスのM RNA分節の配列はサシュペリウイルス日本分離株のM RNA分節の部分配列と、高い相同性があることが判明した。オルソブニャウイルスのような分節ゲノムを持つウイルスでは、同時に2種類のウイルスがひとつの細胞に感染すると、その複製の過程で分節ゲノムの交換が起こり(遺伝子再集合)、由来の異なる分節ゲノムを持った遺伝子再集合体が生じることが知られている。動物衛生研究所でシャモンダウイルスおよびサシュペリウイルスの塩基配列の解析を更に進めた結果、シュマレンベルクウイルスは、シャモンダウイルス由来のSおよびL RNA分節、サシュペリウイルス由来のM RNA分節を持つ、遺伝子再集合体であることを明らかになった(図1、図2)15)。サシュペリウイルスとシャモンダウイルスは、ともにアフリカおよびアジアに広く分布し、同じ脊椎動物宿主(反芻動物)および媒介節足動物(ヌカカ)で増殖するため、これらの地域では過去に同じ個体に同時に感染し、遺伝子再集合を起こす機会があったと考えられる。シュマレンベルクウイルスの外被糖タンパク質をコードするM RNA分節はサシュペリウイルスの日本分離株のそれと、アミノ酸レベルで90%の相同性を有することから、血清学的に両ウイルスは交差反応を示す可能性が考えられる。実際、抗シュマレンベルクウイルス血清によって、サシュペリウイルスの増殖が抑制されることが示されている16)。また、遺伝子レベルで近縁のウイルスと区別するためには、血清群の中で配列の相同性が高いS RNA分節だけでなく、変異の大きいM RNA分節の塩基配列の決定が必要になると思われる。
3)臨床症状
乳牛では、ウイルス感染後短期間の間、高熱、下痢、食欲不振、乳量の低下(50%以下)がみられ、5日間程度のウイルス血症を起こす6)。めん羊、牛、山羊、バイソンでは四肢や脊柱の湾曲、大脳欠損を伴う先天異常子の出産が報告されている。また、流行地では野生のシカや、飼育されているアルパカでも抗体の陽転が報告されているが、臨床症状は確認されていない17,18)。ウイルスの伝播は、媒介者と考えられているヌカカが活動する夏から秋に起こったと思われるが、体形異常を伴う異常子の出産がみられるのは、感染後、数ヶ月を経てからである。異常産の発生は、2011年の秋から冬にかけてはめん羊がほとんどであったが、2012年に入ってからは牛での報告が多くなった10)。これは、めん羊と牛の妊娠期間(それぞれ、約150日と280日)の違いにより、異常子の出産の時期にずれが生じたためと考えられる。他のアルボウイルスと同様、シュマレンベルクウイルスに感染した動物は、ほとんどの場合症状を示さず、発症率はそれほど高くないと予想される。実際、流行が起こった地域では、シュマレンベルクウイルスによる異常産が発生した農家の割合は、めん羊飼養農家で0.07~7.62%、牛飼養農家では0.5~1.32%と推計されている10)。
アカバネ病やアイノウイルス感染症との違いは、臨床症状のひとつとして下痢や乳量の低下がみられることである。アカバネウイルスでは株によって、子牛や育成牛で脳脊髄炎を起こし、起立不能や麻痺などの神経症状を引き起こす例も知られているが19)、シュマレンベルクウイルスに感染した動物では、そのような例は報告されていない。シュマレンベルクウイルスの人への感染例はなく、近縁のウイルスが人への病原性をほとんど持たないことを考えると、疾病を起こすリスクは非常に低いと考えられている20)。
シュマレンベルクウイルスと遺伝学的に近縁なシャモンダウイルスやサシュペリウイルスは、1999年以降、繰り返し我が国に侵入し、西日本で牛に感染していたことが明らかになっているが15,21, 22)、現在のところ疾病の原因として大きな問題とはなっていない。今後、これらのウイルスとシュマレンベルクウイルスとの間の病原性の差異について、検討していく必要があると考えられる。
4)診断
ウイルス分離は、発症牛の血液材料をヌカカ由来の培養細胞(KC cell)に接種し10日間培養後、その培養上清をハムスター腎臓由来の培養細胞(BHK21)で継代して細胞病変を確認することにより行われた6)。また、ウイルス遺伝子の検出のために、S もしくはL RNA分節をターゲットとしたリアルタイムRT-PCR法のプロトコールが公開されている23,24)。抗体の検出には、市販のELISAおよび中和試験、間接蛍光抗体法が用いられる25,26)。市販のELISAは、シンブ血清群ウイルスの共通抗原であるヌクレオカプシド蛋白を用いるため、同血清群の他のウイルスに対する抗体も検出する可能性が高く、使用にあたっては注意が必要である。アカバネ病の場合と同様、感染から数ヶ月を経て出産される先天異常子では、既に体内からウイルスおよびその抗原、遺伝子が消失していることが考えられ、初乳未摂取の異常産子の血清から感染抗体を検出することも必要となる。一方、流産胎子では感染抗体の検出よりも、リアルタイムRT-PCR法の感度が高いことが報告されている24)。
5)伝播経路
シンブ血清群に属する他のウイルスと同様、シュマレンベルクウイルスもCulicoides属のヌカカによって媒介されると考えられる。流行地では、C. scoticus、C. obsoletus、C. chiopterus、C.pulicarisおよびC. dewulfiの5種のヌカカからシュマレンベルクウイルス遺伝子が検出され、これらの種が伝播に関与していたと推測されている27-29)。これらの種は、ヨーロッパ中に広く分布する在来のヌカカであり、新たに熱帯地域から媒介種が侵入、生息域を拡大し、シュマレンベルク感染症の流行を起こしたとの仮説は受け入れられていない。脊椎動物宿主間での接触や飛沫による感染はないと考えられている。高緯度地域では、ヌカカの成虫は冬期には活動しないため、シュマレンベルクウイルスの感染環は遮断されると考えられる。しかし、シュマレンベルクウイルスの感染が2012年の夏期にも再び確認されたことは、ウイルスが何らかの方法で越冬したことを示している。脊椎動物宿主ではウイルス血症が5日程度と短く、翌春までウイルスが体内で保持されたとは考えにくい。従って、感染ヌカカ成虫あるいは、経卵感染した次世代のヌカカが幼虫で越冬することにより、環境中にウイルスが残ったことが推測される。
3.今後の展望
ヌカカの飛翔能力はあまり高くないが、微小な体故に風に乗って長距離(時には、数百キロ)移動をすることが知られている。オーストラリアや中東の例では、ヌカカが媒介するアルボウイルス感染症の流行拡大に、季節風が大きく関わっていたことが報告されている。しかし、シュマレンベルグウイルスの例では、ウイルスの常在地と考えられる熱帯や亜熱帯地域から、直接風に乗ってウイルスに感染したヌカカがヨーロッパ北部に飛来したとは考えにくい。むしろ、常在地から航空機により輸送されたウイルス血症を起こした感受性動物や貨物に紛れ込んだ感染ヌカカを介して、ウイルスが持ち込まれた可能性が否定できない30)。ヨーロッパ北部で2006年にブルータングが発生した際にも同様の考察がなされている31)。今後、様々な地域で分離された近縁のウイルスの解析により、シュマレンベルクウイルスの地理的な由来とその侵入の過程が明らかになると考えられる。
大方の予想に反して、シュマレンベルクウイルスは2011/2012年の冬を越して再びヨーロッパで感染の拡大を起こしている。2012年の夏期には、2011年に感染が拡大した領域に隣接した地域でシュマレンベルクウイルスが検出されている11,12)。脊椎動物宿主では、感染により終生免疫を獲得すると考えられるため、2011年に伝播が起こった地域では異常産の発生は減少し、今後、流行地は徐々にその外側に広がっていくと考えられる。2012年12月以降には、チェコやハンガリー、エストニアといった地域でも異常産例が報告されており、今後、東欧および南欧諸国での感染拡大が懸念されている。また、2012/2013年の冬にもシュマレンベルクウイルスの越冬が起こり得れば、更にその外側に流行は広がることが予想される。シュマレンベルクウイルスに対するワクチンの開発も試みられているが、費用対効果を考えると2006-2007年のブルータング発生時のようにワクチンの広範囲な接種は行われないと思われる。一方、感染雄牛から採取された精液からシュマレンベルクウイルスのRNAが検出されてこと32,33)から、非発生国でも厳密な検疫処置が必要になると考えられる。何れにせよ、ヨーロッパ諸国で行われている研究成果の公表は途上であり、全容が明らかになるにはしばらく時間がかかると思われる。
おわりに
ヌカカが媒介する多くのアルボウイルスは、熱帯や亜熱帯地域に常在していると考えられるが、これらの地域でのサーベイランスは1970年代以降、ほとんど行われていない。今回のシュマレンベルクウイルスをめぐる混乱も、これまで関係各国がこの種のアルボウイルスの進入リスクについて、十分注意を払ってこなかったことが原因のひとつと思われる。我が国には、近隣地域から初夏に季節風に乗って飛来する感染ヌカカを介して、国外からアルボウイルスが侵入すると考えられるため、その玄関口である九州や沖縄といった地域で、これまでどおり継続的に監視を行っていく必要がある。また、気候変動によってアルボウイルスの分布域や、媒介節足動物の活動地域や時期が変化し、我が国への侵入リスクも大きく変わる可能性がある。今後は、東アジアや更にその南に位置する東南アジア諸国と連携して、これらの地域のアルボウイルスの分布状況や季節変動を明らかにし、発生予察に役立てることも考慮されるべきだと考える。
文責:梁瀬 徹(温暖地疾病研究領域)
文献
- 梁瀬 徹(2009)ヌカカが媒介する家畜のアルボウイルス.衛生動物 60: 195-212
- 山川 睦(2011)家畜アルボウイルスの最新流行事情.臨床獣医 28: 12-17
- 相澤真紀,新田芳樹 (2010)沖縄における牛アルボウイルス流行の特徴.臨床獣医 28: 29-33
- Ohashi S, Yoshida K, Yanase T, Kato T, Tsuda T (2004) Simultaneous detection of bovine arboviruses using single-tube multiplex reverse transcription-polymerase chain reaction. J Virol Methods 120: 79-85
- Tsuda T, Yoshida K, Yanase T, Ohashi S, Yamakawa M. (2004) Competitive enzyme-linked immunosorbent assay for the detection of the antibodies specific to akabane virus. J Vet Diagn Invest 16: 571-576
- Hoffmann B, Scheuch M, Höper D, Jungblut R, Holsteg M, Schirrmeier H, Eschbaumer M, Goller KV, Wernike K, Fischer M, Breithaupt A, Mettenleiter TC, Beer M (2012) Novel orthobunyavirus, in cattle, Europe. Emerg Infect Dis 18: 469-472
- Muskens J, Smolenaars AJ, van der Poel WH, Mars MH, van Wuijckhuise L, Holzhauer M, van Weering H, Kock P(2012) Diarrhea and loss of production on Dutch dairy farms caused by the Schmallenberg virus. Tijdschr Diergeneeskd 137: 112-115
- van den Brom R, Luttikholt SJ, Lievaart-Peterson K, Peperkamp NH, Mars MH, van der Poel WH, Vellema P (2012) Epizootic of ovine congenital malformations associated with Schmallenberg virus infection. Tijdschr Diergeneeskd 137: 106-111
- Friedrich Loeffler Institute (2012) Schmallenberg virus.http://www.fli.bund.de/en/startseite/current-news/animal-disease-situation/new-orthobunyavirus-detected-in-cattle-in-germany.html. Accessed 25 March 2012
- European Food Safety Authority (EFSA) (2012) Schmallenberg virus: analysis of the epidemiological data and assessment impact. http://www.efsa.europa.eu/en/efsajournal/doc/2768.pdf. Accessed 7 January 2012
- European Food Safety Authority (EFSA) (2012) Schmallenberg virus: analysis of the epidemiological data (November 2012). http://www.efsa.europa.eu/en/supporting/doc/360e.pdf. Accessed 7 January 2013
- Sailleau C, Bréard E, Viarouge C, Desprat A, Doceul V, Lara E, Languille J, Vitour D, Attoui H, Zientara S (2013) Acute Schmallenberg virus infections, France, 2012. Emerg Infect Dis (in press)
- 農林水産省消費安全局動物衛生課(2012)シュマレンベルクウイルス(Schmallenberg virus)感染症に関する情報.http://www.maff.go.jp/j/syouan/douei/katiku_yobo/pdf/120611_schma_2.pdf. Accessed 9 January 2013
- Plyusnin A, Beaty BJ, Elliott RM, Goldbach R, Kormelink R, Lundkvist Å, Schmaljohn CS, Tesh RB (2012) Bunyaviridae. In: King AMQ, Adams MJ, Carstens EB, Lefkowits EJ (eds) Virus taxonomy: Ninth Report of the International Committee on Taxonomy of Viruses. Elsevier Academic Press, London, pp 725-741
- Yanase T, Kato T, Aizawa M, Shuto Y, Shirafuji H, Yamakawa M, Tsuda T (2012) Genetic reassortment between Sathuperi and Shamonda viruses of the genus Orthobunyavirus in nature: implications for the genetic relationship with Schmallenberg virus. Arch Virol 157: 1611-1616
- Goller KV, Höper D, Schirrmeier H, Mettenleiter TC, Beer M (2012) Schmallenberg virus as possible ancestor of Shamonda virus. Emerg Infect Dis 18: 1644-1646
- Linden A, Desmecht D, Volpe R, Wirtgen M, Gregoire F, Pirson J, Paternostre J, Kleijnen D, Schirrmeier H, Beer M, Garigliany MM (2012) Epizootic spread of Schmallenberg virus among wild cervids, Belgium, Fall 2011. Emerg Infect Dis 18: 2006-2008.
- Jack C, Anstaett O, Adams J, Noad R, Brownlie J, Mertens P (2012) Evidence of seroconversion to SBV in camelids. Vet Rec. 170:603.
- Kono R, Hirata M, Kaji M, Goto Y, Ikeda S, Yanase T, Kato T, Tanaka S, Tsutsui T, Imada T, Yamakawa M (2008) Bovine epizootic encephalomyelitis caused by Akabane virus in southern Japan. BMC Vet Res 4: 20
- Reusken C, van den Wijngaard C, van Beek P, Beer M, Bouwstra R, Godeke GJ, Isken L, van den Kerkhof H, van Pelt W, van der Poel W, Reimerink J, Schielen P, Schmidt-Chanasit J, Vellema P, de Vries A, Wouters I, Koopmans M (2012) Lack of evidence for zoonotic transmission of Schmallenberg virus. Emerg Infect Dis 18: 1746-1754
- Yanase T, Fukutomi T, Yoshida K, Kato T, Ohashi S, Yamakawa M, Tsuda T (2004) The emergence in Japan of Sathuperi virus, a tropical Simbu serogroup virus of the genus Orthobunyavirus. Arch Virol 149: 1007-1013
- Yanase T, Maeda K, Kato T, Nyuta S, Kamata H, Yamakawa M, Tsuda T (2005) The resurgence of Shamonda virus, an African Simbu group virus of the genus Orthobunyavirus, in Japan. Arch Virol 150: 361-369
- Bilk S, Schulze C, Fischer M, Beer M, Hlinak A, Hoffmann B (2012) Organ distribution of Schmallenberg virus RNA in malformed newborns. Vet Microbiol 159: 236-238
- De Regge N, van den Berg T, Georges L, Cay B (2012) Diagnosis of Schmallenberg virus infection in malformed lambs and calves and first indications for virus clearance in the fetus. Vet Microbiol (in press)
- Loeffen W, Quak S, de Boer-Luijtze E, Hulst M, van der Poel W, Bouwstra R, Maas R (2012) Development of a virus neutralisation test to detect antibodies against Schmallenberg virus and serological results in suspect and infected herds. Acta Vet Scand 54: 44
- Mansfield KL, Rocca SA, Khatri M, Johnson N, Steinbach F, Fooks AR (2012) Detection of Schmallenberg virus serum neutralising antibodies. J Virol Methods (in press)
- Science (2012) Schmallenberg vectors found. Science 235: 1422
- Rasmussen LD, Kristensen B, Kirkeby C, Rasmussen TB, Belsham GJ, Bødker R, Bøtner A (2012) Culicoides as vectors of Schmallenberg virus. Emerg Infect Dis 18: 1204-1206
- Elbers AR, Meiswinkel R, van Weezep E, Sloet van Oldruitenborgh-Oosterbaan MM, Kooi EA (2013) Schmallenberg virus in Culicoides spp. Biting Midges, the Netherlands, 2011. Emerg Infect Dis 19: 106-109
- Kupferschmidt K (2012) Infectious disease. Scientists rush to find clues on new animal virus. Science 335: 1028-1029
- Mintiens K, Méroc E, Mellor PS, Staubach C, Gerbier G, Elbers AR, Hendrickx G, De Clercq K (2008) Possible routes of introduction of bluetongue virus serotype 8 into the epicentre of the 2006 epidemic in north-western Europe. Prev Vet Med 87: 131-144
- ProMED 20121220.1460864. (2012) Schmallenberg virus-Europe (76): Virus RNA in bovine semen.http://www.promedmail.org/direct.php?id=20121220.1460864. Accessed 8 January 2013
- ProMED 20121221.1462748. (2012) Schmallenberg virus-Europe (77): (NL, FR) Virus RNA in bovine semen. http://www.promedmail.org/promedprint.php?id=1462748. Accessed 8 January 2013

