異常プリオン蛋白質には性質の異なる複数の蛋白質分子が存在する
要約
異常プリオン蛋白質は、感染性、凝集活性、蛋白質分解酵素耐性を示す。感染動物においてこれらの性状の経時変化を詳しく調べると、異常プリオン蛋白質には性質の異なる複数の蛋白質分子がある。
- キーワード:プリオン、感染性、凝集活性、蛋白質分解酵素耐性
- 担当:動物衛生研究部門・ウイルス・疫学研究領域・感染生態ユニット
- 代表連絡先:
- 分類:研究成果情報
背景・ねらい
プリオン病の病原体「プリオン」の本体は異常プリオン蛋白質であり、ヒトを含む動物体内にある正常プリオン蛋白質の立体構造が変化したものである。感染した個体では、異常プリオン蛋白質が蓄積した結果、神経細胞が変性・脱落し発症する。
異常プリオン蛋白質の特徴として、①感染性、②凝集活性、③蛋白質分解酵素耐性を持つことが知られており、これらの性状を基に異常プリオン蛋白質の検出が行われている。最も重要である感染性の検出は時間を要することから、一般的に凝集活性と蛋白質分解酵素耐性が検出指標として用いられている。しかし、感染性と他の指標の関連性について完全に明らかになっておらず、そのためプリオンの感染性に対する不活化処理の効果を評価する際、検出指標により結果が異なることが問題となる。
そこで本研究では、これらの活性の関係性を明らかにすることを目的とし、プリオン感染動物で異常プリオン蛋白質が増幅する際の各活性の経時的な変化を詳細に調べる。マウス馴化牛海綿状脳症(BSE)プリオンをマウスに脳内接種し、感染マウス脳を経時的に採取する。脳に蓄積した異常プリオン蛋白質の①感染性、②凝集活性、③蛋白質分解酵素耐性を各々、①マウスバイオアッセイ法、②real-time quaking-induced conversion (RT-QuIC)法、③ELISA法を用いて測定する。
成果の内容・特徴
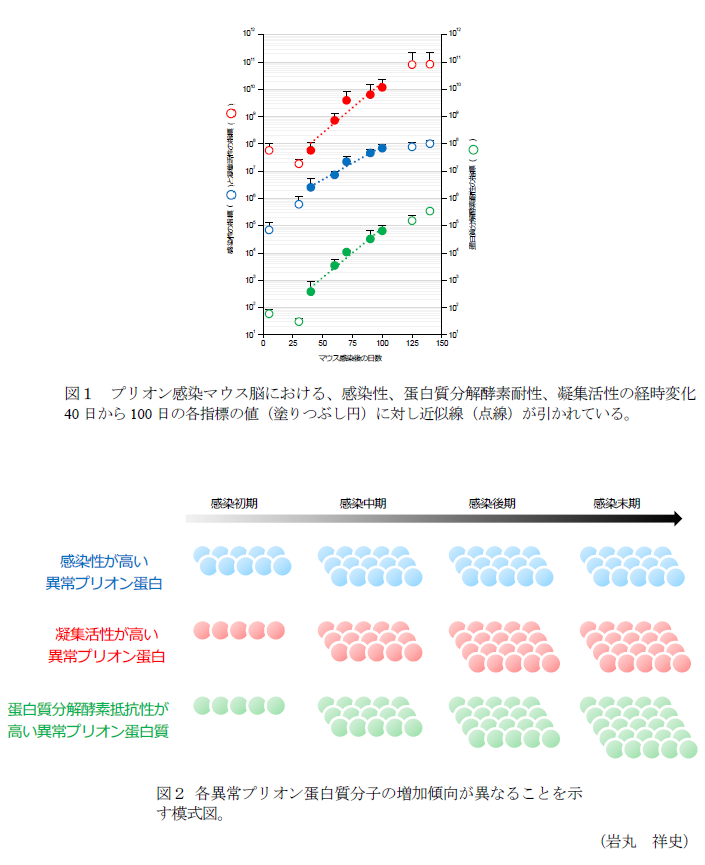
- 感染後5から25日のマウス脳内では、感染性の指標が増加しているのに対し、凝集活性と蛋白質分解酵素耐性の指標は一過性に減少している(図1)。
- 感染後40から100日のマウス脳内では、近似線の解析により、凝集活性と蛋白質分解酵素耐性の指標の倍加速度が類似する(図1、点線)。
- 感染後100から125日のマウス脳内では、感染性の指標は定常に達しているのに対し、凝集活性と蛋白質分解酵素耐性の指標の増加が続く(図1)。
- 感染後125から140日のマウス脳内では、蛋白質分解酵素耐性活性の指標のみ増加が続く(図1)。
- 各指標の増加傾向が異なることから、異常プリオン蛋白質には性質の異なる複数の蛋白質分子が混在して存在すると考えられる(図2)。
- プリオンに対する不活化処理の効果を正確に評価するためには、感染性の指標を用いた評価が重要である。
成果の活用面・留意点
- マウス馴化BSEプリオンを野生型マウスに接種した際の結果であり、他のプリオン株と他種動物においても同様の傾向を示すか確認する必要がある。
具体的データ
その他
- 予算区分:交付金、委託プロ(国内侵入)
- 研究期間:2018~2020年度
- 研究担当者:岩丸祥史、松浦裕一、宮澤光太郎
- 発表論文等:Iwamaru Y. et al. (2020) Pathogens. 9(3):241. doi: 10.3390/pathogens9030241.
