創薬に有用な「高い経内皮電気抵抗値を有するヒト微小血管内皮培養モデル」の開発
要約
ヒト血管内皮細胞をコラーゲンビトリゲル膜上で培養して、高い経内皮電気抵抗値を有するヒト微小血管内皮培養モデルを開発した。この培養モデルは、「生理活性物質が引き起こす内皮バリア機能の変動の定量的評価」と「内皮バリアを透過する物質の解析」に使用でき、創薬に有用であることが示唆された。
- キーワード:創薬、コラーゲンビトリゲル膜、微小血管内皮細胞、内皮バリア機能、ヒスタミン
- 担当:生物機能利用研究部門・ビトリゲル特命プロジェクト
- 代表連絡先:
- 分類:研究成果情報
背景・ねらい
医薬品は、全身の毛細血管を構成する微小血管内皮細胞が形成する内皮バリアを透過することで患部に到達し薬効を発揮する。また、生理活性物質が引き起こす内皮バリア機能の変動は、アレルギーなど様々な疾患の発症に関係している。したがって、「生理活性物質が引き起こす内皮バリア機能の変動の定量的評価」と「内皮バリアを透過する物質の解析」は、創薬において不可欠である。しかし、従来の血管内皮の培養モデルは経内皮電気抵抗値が低く定量的なアッセイが困難であるため、動物実験を代替するには至っていない。本研究では、コラーゲンビトリゲル膜を利用して、創薬に有用な「高い経内皮電気抵抗値を有するヒト微小血管内皮培養モデル」を開発することを目指した。
成果の内容・特徴
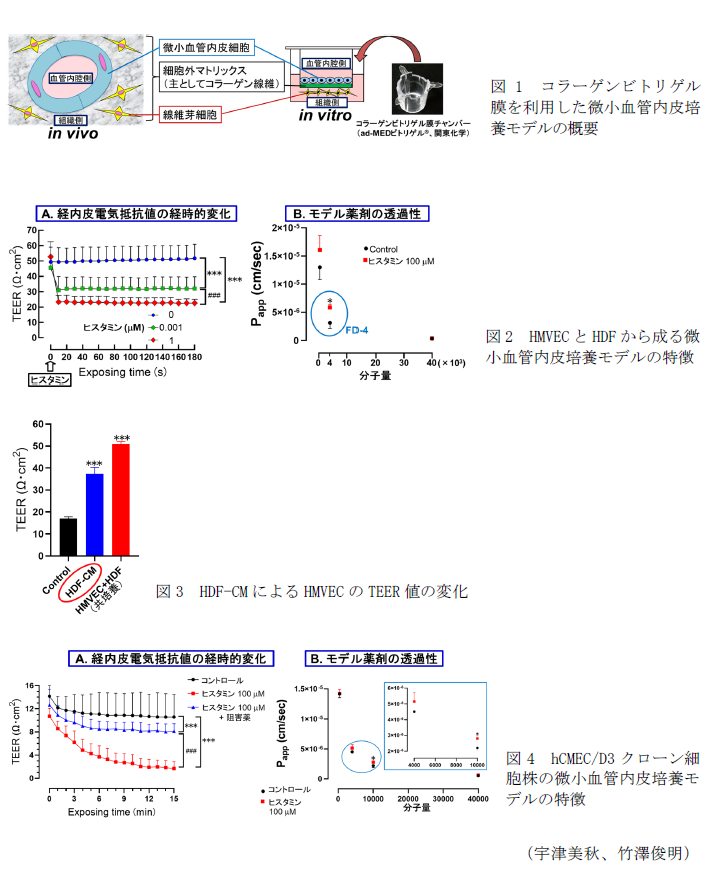
- 生体内の毛細血管を反映した培養モデルは、コラーゲンビトリゲル膜を介して微小血管内皮細胞と線維芽細胞を共培養することで構築できる(図1)。
- 新生児包皮由来のヒト微小血管内皮細胞(HMVEC)とヒト線維芽細胞(HDF)から成る微小血管内皮培養モデルは、経内皮電気抵抗(TEER)値が50 Ω・cm2まで上昇し、生理的な濃度のヒスタミンに鋭敏に応答してTEER値が減少することから、ヒト体内の毛細血管の挙動を十分に再現できると考えられる(図2A)。さらに同モデルにおいてモデル薬剤の透過係数(Papp)を測定すると、分子量4,000の薬剤(FD-4)の透過性のみがヒスタミン曝露によって亢進する(図2B)。このような分子量選択的な薬剤透過性の変化は過去に報告例がなく、創薬における有用な知見である。
- HDFを培養した馴化培養液(HDF-CM)をコラーゲンビトリゲル膜チャンバー内で培養したHMVECに加えるとHDFと共培養した場合(HMVEC+HDF)の73%までTEER値が上昇する(図3)。本成果は、HDF-CM を用いることでHMVECのみの単純な培養系で内皮バリア機能を評価できることを示唆する。
- 市販のヒト大脳由来微小血管内皮細胞株hCMEC/D3はHMVECと比較して増殖性や培養コストの面で優れている反面、内皮バリア機能が非常に低く定量的な評価に使用できない。そこで、本細胞株より内皮バリア機能の高いクローン細胞株を選別しコラーゲンビトリゲル膜チャンバー内で培養すると、TEER値は15 Ω・cm2まで上昇するが、ヒスタミンによってTEER値が減少する(図4A)。さらに、ヒスタミンシグナル阻害薬によりヒスタミンの作用が抑制されるから、本クローン細胞株は高いヒスタミン応答性を示す。また、本クローン細胞株においても、ヒスタミン曝露時にモデル薬剤の透過性は分子量選択的に亢進する(図4B)。本クローン細胞株を用いた微小血管内皮培養モデルは、HMVECとHDFから成るモデルと同様の特徴を有し、且つ汎用性が高い。
成果の活用面・留意点
- 開発した微小血管内皮培養モデルは、ヒト毛細血管の「生理活性物質が引き起こす内皮バリア機能の変動」および「内皮バリアを透過する物質」を予測するツールとしての活用が期待される。
- 得られたhCMEC/D3のクローン細胞株は増殖性に優れているので、更に内皮バリア機能を向上できるか検討する。
具体的データ
その他
- 予算区分:交付金(令和元年度NIP)
- 研究期間:2019~2020年度
- 研究担当者:宇津美秋、竹澤俊明(生物研)
- 発表論文等:
- Uzu M and Takezawa T. Novel microvascular endothelial model utilizing a collagen vitrigel membrane and its advantages for predicting histamine-induced microvascular hyperpermeability. (2020) J Pharmacol Toxicol Methods. 106:106916
doi: 10.1016/j.vascn.2020.106916 - 竹澤俊明、宇津美秋.血液組織関門インビトロモデル、及び薬物の血液組織関門移行性評価方法.PCT/JP2020/ 38721(出願日:2020年10月14日)
- Uzu M and Takezawa T. Novel microvascular endothelial model utilizing a collagen vitrigel membrane and its advantages for predicting histamine-induced microvascular hyperpermeability. (2020) J Pharmacol Toxicol Methods. 106:106916
