植物のRNAサイレンシング増幅機構を試験管内で解析する実験系
要約
植物において小分子RNAを介したRNAサイレンシングは、ウイルスに対する重要な防御機構の一つである。この機構ではウイルスのRNAに相同な配列を持つ21塩基程度の小分子RNAを宿主作物が増幅し、ウイルスの増殖を抑制するしくみの存在が知られている。小分子RNAの増幅機構を試験管内で観察できる実験系の確立を通して、植物体を使った観察では得ることが困難な新たなウイルス制御法の開発に向けた基盤知見が得られるとともに、ウイルスを使ったゲノム編集の効率化に適用できる基盤知見の取得が期待できる。
- キーワード:小分子RNA、ウイルス抵抗性、RNAサイレンシング、ゲノム編集効率化
- 担当:生物機能利用研究部門・作物生長機構研究領域・作物病害制御機構グループ
- 代表連絡先:
- 分類:研究成果情報
背景・ねらい
植物において小分子RNAを介したRNAサイレンシングは、ウイルスに対する重要な防御機構の一つである。この機構ではウイルスのRNAに相同な配列を持つ21塩基程度の小分子RNAを宿主作物が増幅し、ウイルスの増殖を抑制するしくみの存在が知られている。小分子RNAの増幅機構を試験管内で観察できる実験系の確立を通して、植物体を使った観察では得ることが困難な新たなウイルス制御法の開発に向けた基盤知見が得られる。
植物のゲノム編集においては、アグロバクテリウム法や直接導入法によりゲノム編集酵素を導入した培養細胞からの個体再分化が広く用いられるが、主要作物では培養細胞からの個体再分化が困難なものが多く、一般に培養細胞を使ったアグロバクテリウム法および直接導入法のいずれも適用は困難である。一方、ウイルスを使ったゲノム編集においては、感染宿主となる作物個体にゲノム編集酵素遺伝子を組み込んだウイルスを感染させ、個体再分化を経ることなくゲノム編集個体を得ることが可能であり、さまざまな主要作物への適用が可能である。しかし、ゲノム編集酵素遺伝子を組み込んだウイルスは野生型ウイルスと比較して増殖や作物個体内伝搬の能力が劣り、宿主作物のRNAサイレンシングにより不活化される可能性が高まる。ウイルスに対する宿主のRNAサイレンシングの重要なステップである小分子RNA増幅の仕組みに係る仕組みを明らかにすることで、ゲノム編集酵素を組込んだウイルスの増殖制御とゲノム編集の効率化に適用できる基盤知見の取得が期待できる。
そこで、本研究ではタバコ及びシロイヌナズナ培養細胞抽出液を使って試験管内で小分子RNA増幅の各ステップの精密な解析を行い、これまで明らかになっていなかった分子機構の解明を通して、ウイルスによるゲノム編集の効率化に向けた基盤知見の取得が可能となる。
成果の内容・特徴
- 本研究成果は、植物における小分子RNAの増幅に係る酵素群を試験管内で作製・混合することにより通常は宿主作物細胞内で起こるウイルスの増殖抑制反応の一端を試験管内で再現する実験系の開発に係る。
- 植物個体内でのウイルスの増殖抑制ではウイルスRNAに相同な小分子RNAの増幅ステップが重要であり、本研究で開発した試験管内解析系を使うことで、このステップに係る酵素の機能が明らかになる。
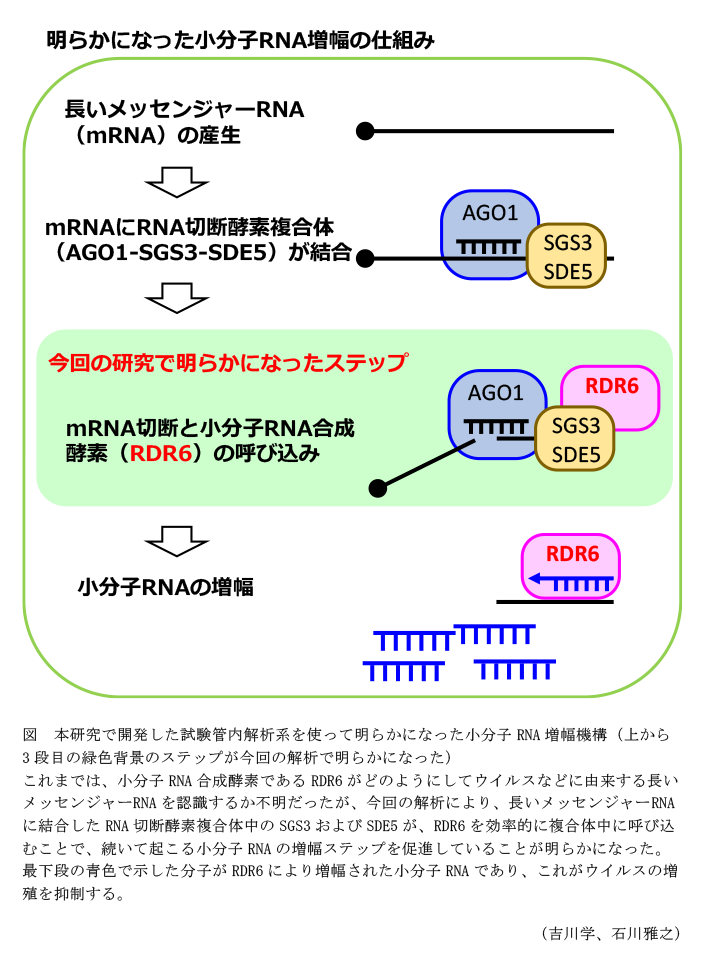
- 開発した試験管内解析系を用いて、小分子RNAの増幅に係る酵素のうちRNA切断酵素複合体に含まれるSGS3およびSDE5と小分子RNA合成酵素であるRDR6の相互作用が効率的な小分子RNA増殖に係ることが示される(図)。
成果の活用面・留意点
- 本研究で開発した試験管内解析系は、RNAサイレンシングに係る酵素の機能改変による新たなウイルス抵抗性作物の開発に活用できる。
- 本研究で開発した試験管内解析系により得られる知見は、ゲノム編集酵素遺伝子を組み込んだウイルスの増殖制御によるゲノム編集効率化への活用が期待できる。
具体的データ
その他
- 予算区分:交付金、文部科学省(科研費)
- 研究期間:2016~2021年度
- 研究担当者:吉川学、石川雅之、韓龍雲(理研)、藤井裕史(東京理科大学)、相澤秀(東京理科大学)、西野達哉(東京理科大学)
- 発表論文等: Yoshikawa M. et al. (2021) Proc. Natl. Acad. Sci. USA 118:e2102885118
