あらゆるカイコ品種に対応可能なゲノム編集カイコ・遺伝子組換えカイコ作出基盤の構築
要約
クローンカイコにおいては蛹化直後に食道下神経節を除去して非休眠卵を産卵させる。実用系統においては休眠卵をDMSO溶媒に浸漬、もしくはコロナ放電を照射して休眠を打破する。これらの技術により、あらゆるカイコ品種において、遺伝子組換えやゲノムを行うことが可能となる。
- キーワード : カイコ、実用品種、遺伝子組換え、ゲノム編集、休眠、有用物質生産
- 担当 : 生物機能利用研究部門・絹糸昆虫高度利用研究領域・新素材開発グループ・山田信人
- 代表連絡先 :
- 分類 : 研究成果情報
背景・ねらい
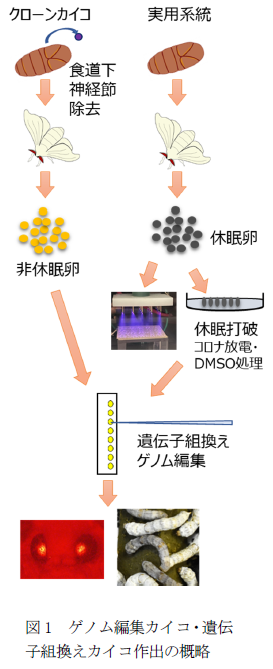
遺伝子組換えカイコやゲノム編集カイコの作出には、発生初期の産卵後8時間以内に遺伝子を注射する必要がある。そして、発生が停止する休眠卵では、遺伝子組換えカイコやゲノム編集カイコを得ることができない。そこで、休眠しない非休眠卵を産む特殊なカイコ(実験用)系統が開発され、組換えカイコやゲノム編集カイコの作出に用いられてきた。しかし、実験用系統のシルク生産能力は低く、実用化のためには生産性が高い実用系統カイコとの掛け合わせが必要である。
また、医薬品などの原料となる有用物質を生産する遺伝子組換えカイコの開発が進められている。培養細胞で生物製剤の製造する際には、製品の承認にマスターセルバンク(MCB)およびワーキングセルバンク(WCB)の確立が求められる。カイコにおいて生物製剤を生産する場合、今のところ確立した医薬品を製造するための要件をまとめたGMP(Good Manufacturing Practice)はないが、遺伝的に均一なクローンカイコであれば、バンク化は容易である。カイコには単為発生しやすい単為発生系統が存在し、それらは同系統内では遺伝的背景が同じクローンカイコである。したがって、この単為発生カイコを遺伝子組換えして有用物質生産カイコとして使用することができれば、上記の課題をクリアできる。しかしながら、単為発生系統は休眠卵を産むことが遺伝的に決まっているため非休眠化が極めて難しく、遺伝子組換え体を得ることが困難という問題点があった。
上記のような課題を克服するためには、実用系統カイコやクローンカイコの卵に遺伝子を直接注射して組換えカイコ・ゲノム編集カイコが作出できれば、開発時間が短縮可能である。非休眠卵を得る方法として、非休眠卵を産卵させる方法と、産卵された休眠卵の休眠を打破する方法が考えられる。
前者としては、休眠ホルモンを産生する食道下神経節を蛹化2日以内に除去すると、非休眠卵を産ませられることが知られている。そこで本研究では、食道下神経節を除去した単為発生系統から非休眠卵を得ることで、単為発生系統を遺伝子組換えやゲノム編集に用いることができるのではないかと考えた。後者の方法としては、産卵後20時間で塩酸に浸漬する方法が用いられている。遺伝子組換えやゲノム編集を行うために注射した後は卵殻に穴が空き、塩酸に浸漬に耐えられない。また、産卵直後に塩酸に浸漬した後、遺伝子組換え・ゲノム編集処理を行うと、孵化率が大幅に低下する。そこで我々は、DMSO浸漬法、コロナ放電照射法を用い休眠打破した実用系統カイコで遺伝子組換え・ゲノム編集を行う事を考えた(図1)。
成果の内容・特徴
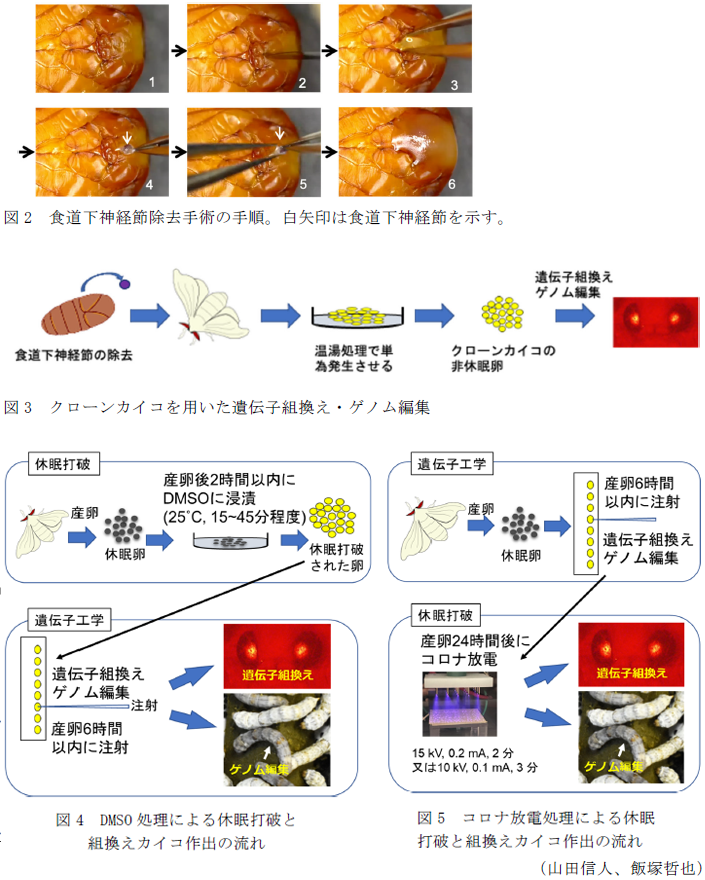
- 食道下神経節除去手術の手順は図2に示す。操作は双眼実体顕微鏡下で行う。最初に蛹化2日以内の蛹を水に30~60分沈めて水麻酔をかける。蛹の腹側頭部にメスで切り込みを入れる。切れ込みからピンセットを入れると小豆色の食道下神経節が見られるため、ピンセットで摘んで引っ張り出し、別の手で持ったピンセットを用いて食道下神経節を神経から切断して除去する。最後に熱で溶かしたパラフィンで覆い傷を塞ぐ。
- 羽化した手術個体を2日程度5°Cで冷却させてから室温(25°C)に戻し産卵させるか、雌蛾から卵巣を摘出して卵巣卵を取り出す。
- 得られた卵を24時間室温で管理した後に、常法にならい46°C18分間の湯温処理を行い、単為発生させる。単為発生処理を行った卵は非休眠卵となり、発生を開始するので、この卵に遺伝子を注射して遺伝子組換えやゲノム編集を行う (図3)。
- 実用系統カイコの休眠卵は、産卵後2時間以内に室温のDMSO溶媒に15~45分間浸漬し、その直後に注射による卵への遺伝子注入を行うことで組換えカイコが得られ(図4)、同様の方法で実用系統カイコの組換え体作出に成功した。DMSOは塩酸より毒性が低いため、扱いも容易である。
- 実用系統カイコが産卵した休眠卵に産卵後6時間以内で遺伝子を注射し、その18時間後にコロナ放電を照射すると塩酸処理をすることなく、孵化して組換えカイコが得られた(図5)。注射翌日でも操作可能なため、実験スケジュールに余裕が生まれる。
- どちらの操作も高度な作業を必要とせず、比較的簡単に行うことができる。
成果の活用面・留意点
- 食道下神経節の除去を行うと産卵開始のシグナルが消失し、産卵しないことがあるが、その際は産卵促進効果の知られているピロカルピンを0.1%の濃度で腹部に注射すると産卵を開始する。
- 遺伝子組換えカイコによるバイオ医薬品のバンク構築に向けて、クローンカイコ技術は極めて有望である。卵巣の凍結保存技術と合わせれば、凍結による長期保存も可能である。
- DMSO処理は、品種によって適切な処理時間が少し異なるため、事前検討が必要である。
- 注射後にコロナ放電処理を行う場合、スライドグラスは絶縁体であるため紙などに卵を並べて注射する必要がある。
- 直接実用系統で組換えカイコを作製できるため、組換えシルクや有用物質生産に用いる組換えカイコの実用化までの期間を大幅に短縮できる。
具体的データ
その他
- 予算区分 : 交付金、大日本蚕糸会
- 研究期間 : 2020~2022年度
- 研究担当者 : 山田信人、米村真之、小島桂、酒井弘貴、飯塚哲也、小林功、内野恵郎、瀬筒秀樹、Valeriya Zabelina(University of South Bohemia)、田村俊樹(蚕糸科学技術研究所)
- 発表論文等 :
- Yamada et al. (2022) J. Insect Physiol. 142:104438
- Yamada et al. (2022) J. Insect Biotechnol Sericology. 91(2):27-32
- Yamada et al. (2023) JARQ. 57(1):63-72
- 米村ら 休眠卵を用いた遺伝子組換えカイコの作製方法 (2022) 特願2022-072682
