カルパイン3はカルパイン1, 2の基質となるだけでなくカルパイン1, 2を基質とし切断する
要約
タンパク質分解酵素であるカルパインは骨格筋細胞において3種類(カルパイン1、2、および3)が発現する。カルパイン3はカルパイン1および2を切断するとともに、カルパイン1および2により切断され、相互に分解を活性化させるフィールドバックの仕組みが存在する。
- キーワード : カルパイン、タンパク質分解酵素、骨格筋、食肉
- 担当 : 畜産研究部門・食肉用家畜研究領域・食肉品質グループ
- 代表連絡先 :
- 分類 : 研究成果情報
背景・ねらい
カルパインはカルシウムイオンにより活性化されるタンパク質分解酵素であり特異的な基質のみを限定的に切断する。生体では様々な生命現象にカルパインの酵素活性が関与している。また、食肉の熟成過程では、カルパインが骨格筋細胞内の主要な構造タンパク質を切断することで、骨格筋を食肉としての適度なかたさに変化させる。骨格筋細胞にはカルパイン1、2、および3の3種類が発現し、これまで、カルパイン1がカルパイン2の一部を切断しカルパイン2の活性化を誘起することが知られていた。しかし、カルパイン3を含めてカルパイン間における酵素学的な相互作用は不明である。そこで本研究では、カルパイン1、2、3がタンパク質分解酵素としての機能発現するために必要な、3者間における相互依存的な活性の仕組みを明らかにする。
成果の内容・特徴
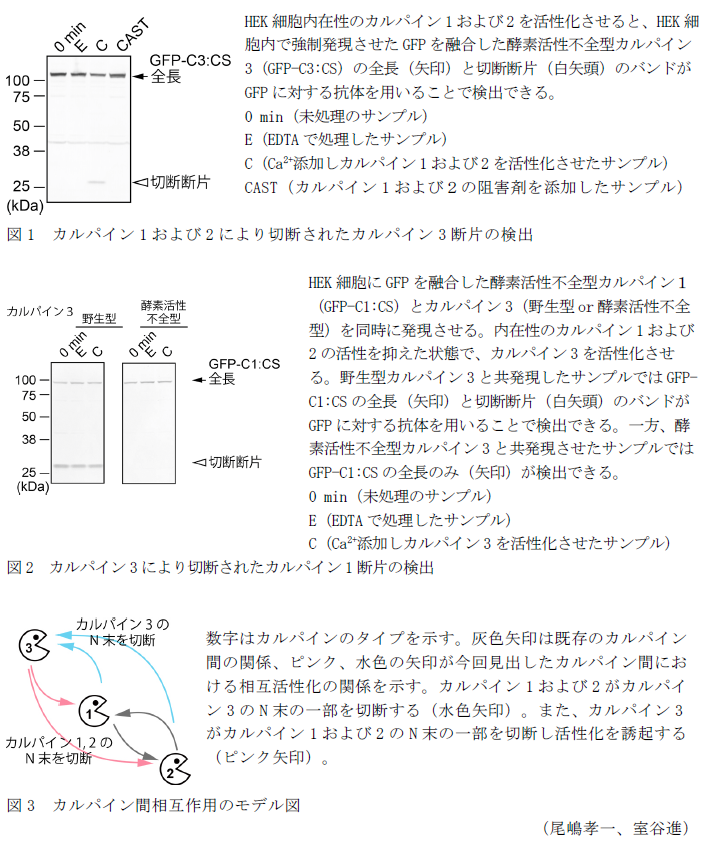
- HEK(ヒト胎児腎臓由来)細胞内在性のカルパイン1および2を活性化させると、HEK細胞内で強制発現させたカルパイン3の切断断片が検出できる(図1)。すなわち、カルパイン3はカルパイン1および2の基質となる。また、カルパイン1および2によるカルパイン3の切断個所はカルパイン3が活性する際に自己切断する部位と同一である。
- HEK細胞内在性のカルパイン1および2の活性を抑えた状態で強制発現させたカルパイン3を活性化させると、カルパイン3によりカルパイン1および2のN末側が切断され、その切断断片検出できる(図2)。すなわちカルパイン3はカルパイン1および2を基質とする。
- カルパイン1、2および3の酵素活性発現の相互関係を示す(図3)。これまでカルパイン1および2の間にのみ相互関係が報告されていたが、新たにカルパイン3がカルパイン間の相互作用に組み込まれることが明らかになった。カルパイン1および2が活性化する際にはN末側を自己切断することが知られているため、カルパイン3がカルパイン1およびカルパイン2のN末側を切断することでカルパイン1および2の酵素活性を誘起すると考えられる。
成果の活用面・留意点
- 食肉熟成過程においてはカルパインの作用により食肉が軟化するため、食肉品質にカルパインの酵素活性が関与する。そのため、得られたデータは食肉の熟成過程における基礎的知見として役立つ。
- 細胞内で目的のタンパク質を強制発現させた系を用いた実験結果である。また、モデル動物としてマウスを使った試験である。
具体的データ
その他
- 予算区分 : 文部科学省(科研費)
- 研究期間 : 2019~2023年度
- 研究担当者 : 尾嶋孝一、秦勝志(都医学研)、大内史子(都医学研)、小野弥子(都医学研)、室谷進
- 発表論文等 : Ojima K. et al. (2023) J. Biochem. 174:421-431
