耐塩性キラー酵母Pichia farinosaの生産するキラー因子の構造とプロセシング機構
※アーカイブの成果情報は、発表されてから年数が経っており、情報が古くなっております。
同一分野の研究については、なるべく新しい情報を検索ください。
要約
耐塩性キラー酵母Pichia farinosaの生産するキラー因子はαとβからなる2量体である。それらの遺伝子は1本のオープンリーディングフレームにコードされ、そこから翻訳される前駆体から酵素的プロセシングを受けて分泌される。
- 担当:食品総合研究所・応用微生物部・糸状菌研究室
- 代表連絡先:0298-38-8077
- 部会名:食品
- 専門:バイテク
- 対象:
- 分類:研究
背景
酵母には蛋白性の物質を分泌して他の酵母の生育を阻害するキラー現象が知られている。味喰、醤油、漬物等の製造工程において、フレーバー生成に重要な役割を果たしている耐塩性酵母にキラー現象を応用することにより、発酵工程の新しい制御技術の開発が可能になる。本研究は本研究室で分離した耐塩性キラー酵母Pichia farinosa KK1株が生産するキラー因子(SMK トキシン)とそれをコードするキラー遺伝子の構造およびその分泌過程の解明を目的とした。
成果の内容・特徴
- 本キラー因子は高濃度食塩存在下でより強いキラ一活性を示す。
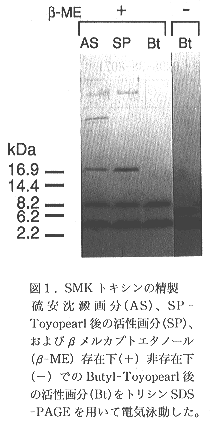
- 本キラー因子の精製を行った結果、トリシンSDS-PAGE上で4kDaと8kDaを示すαとβの2つのサブユニットからなる2量体であることが明らかになった(図1)。
- キラー因子をコードするキラー遺伝子のクローニングを行った結果、αとβの配列は222アミノ酸をコードする1本のオープンリーディングフレーム上に存在した。このことは2つのサブユニットが1つの前駆体(プレプロトキシン)から生じることを示唆している。
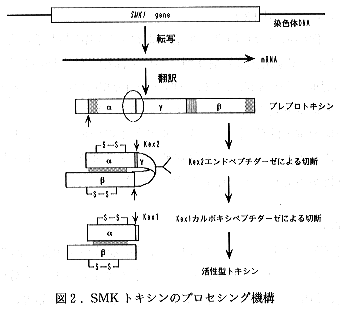
- αサブユニットのC末端はプレプロトキシンの-Val81-Lys82-Arg83-Ser84-のVal81に相当した。この結果は本キラー因子のプロセシングの過程が、真核生物において広く見いだされているプロセシングの過程-2つの塩基性アミノ酸を認識するエンドペプチダーゼKex2による塩基性アミノ酸のC末端側での切断とそれに続くカルボキシペプチダーゼKex1によるC末端塩基性アミノ酸の除去一と極めて類似したプロセスによって起こることを示唆している(図2)。
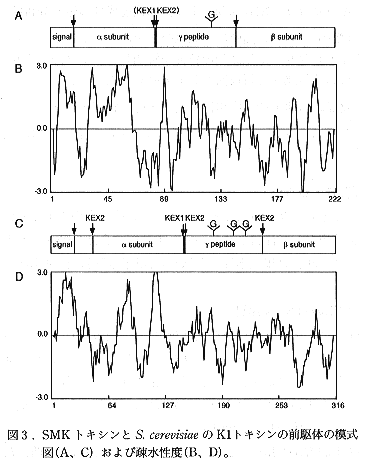
- 本キラー因子の1次配列は既知のタンパク質のアミノ酸配列とホモロジーを示さなかった。しかし、Saccharomyces cerevisiaeの生産するキラー因子、K1トキシンとはその前駆体構造、疎水性度の分布およびプロセシングの過程が非常に類似していることが明らかになった(図3)。
成果の活用面・留意点
本課題により、P. farinosa KK1株の生産するキラー因子の構造および前駆体から活性型キラー因子へのプロセシングの過程が明らかになった。高濃度食塩存在下で分泌される低分子量のキラー因子としては他に例がなく、活性発現機構の解明により、より広い応用が可能になるものと思われる。
具体的データ
その他
- 研究課題名:耐塩性キラー酵母のキラー因子の作用機作の解明/酵母表層に存在する糖鎖レセプターの構造と機能の解明
- 予算区分:経常/糖質工学
- 研究期間:平成5年度(平成3~5年/平成3~8年)
- 研究担当者:鈴木チセ、新国佐幸
- 発表論文等:The primary and subunit structure of a novel type killer toxin produced by a halotolerant yeast,Pichia farinosa.J.Biol.Chem.vol.269(4), 1994.
