ダイズβ-アミラーゼの構造と機能
※アーカイブの成果情報は、発表されてから年数が経っており、情報が古くなっております。
同一分野の研究については、なるべく新しい情報を検索ください。
要約
ダイズβ-アミラーゼに対応するcDNAをクローニングし、その構造を解析した。大腸菌での当該酵素の発現系の構築・発現条件および高度な精製法の確立に成功し、この手法を用いてβ-アミラーゼの触媒残基、Asp101とGlu186、を世界で初めて決定した。
- 担当:食品総合研究所・生物機能開発部・微生物機能工学研究室
- 代表連絡先:0298-38-8137
- 部会名:食品
- 専門:バイテク
- 対象:豆類
- 分類:研究
背景
β-アミラーゼは、澱粉やグリコーゲンなどのα-1、4-グルカンの非還元末端からβ-アノマー型マルトースの遊離を触媒する酵素であり、医薬・食品産業で頻用されているマルトースの製造に欠かせない。一方、α-アミラーゼは、同じ基質に作用するものの、反応生成物のアノマー型、作用様式がβ-アミラーゼのそれと異なる上に、一次構造上の類似性もない。この事は、高分機能X線構造解析が完成し、活性残基が推定され、且つ部位特異的変異により、それが確認されているタカアミラーゼの結果を利用出来ない事を意味している。
本研究課題では、β-アミラーゼの活性発現に必須なアミノ酸残基(いわゆるcatalytic residues)を同定する事を目的とした。
成果の内容・特徴
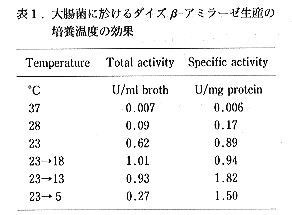
- 発現プラスミドpBAMNE1を用いて、ダイズβ-アミラーゼの大腸菌に於ける効率的生産条件について、培養温度の面から検討した(表1参照)。その結果、ダイズβ-アミラーゼを菌体内で分解されず活性のある形で生産する為に、23°CでA650が0.8付近になるまで培養した後、終濃度1mMになる様にIPTGを添加し、その培養温度を18°Cに下げ、更に15時間培養するという方法を確立した。
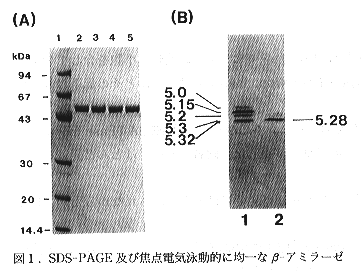
- 少量の菌体から効率的にβ-アミラーゼを高度に精製する方法として、アフィニティークロマトグラフィーは最も優れているので、この方法のダイズβ-アミラーゼヘの適用条件の詳細検討を行った。その結果、1Mの硫安存在下でダイズβ-アミラーゼは特異的にα-サイクロデキストリンカラムと結合し、硫安濃度を下げる事により、溶出が可能である事を発見した(表2参照)。このアフィニティー法を用いる事により、大腸菌からSDS-電気泳動的に、焦点電気泳動的に均一なまでにβ-アミラーゼを精製する方法を確立した(図1参照)。
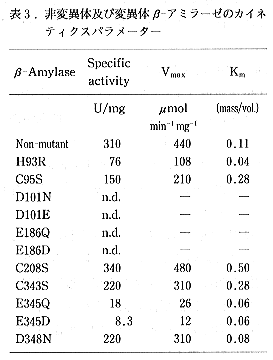
- non-mutant IIの領域内にあるHis、Cys、Asp及びGlu残基を部位特異的変異法により種々のアミノ酸に変換した結果、Asp101とGlu186を、各々他の酸性アミノ酸並びに中性アミノ酸に変換した場合にのみβ-アミラーゼ活性が完全に消失した(表3参照)。活性のない各変異β-アミラーゼタンパク質のCDスペクトルとα-サイクロデキストリンカラムへの結合量を、non-mutant IIと比較したが、有意な差は認められなかった。Glu186はアフィニティーラベリング法によりβ-アミラーゼの活性残基ではないかと考えられていたので、本研究により確認された事になる。これら2つの残基(Asp101とGlu186)がβ-アミラーゼの活性中心を構成していると考えた。
成果の活用面・留意点
β-アミラーゼの活性中心を構成しているアミノ酸残基がAsp101とGlu186の2つの残基である事を世界で初めて明らかにした。この事により、新機能酵素の創製を行う上で一つの重要な知見を得られた。
日本、英国、スウェーデンで特許を申請中である。
具体的データ

その他
- 研究課題名:タンパクエ学的手法による酵素機能の発現機構の解明
- 予算区分:大型別枠(生物情報)
- 研究期間:平成5年度(平成3~5年)
- 研究担当者:深澤親房
- 発表論文等:Affinity purification of β-amylases originating from plant using cyclomaltohexaose-immobilized Sepharose 6B in the presence of ammonium sulfate,Protein Expression and Purification 4,333-336(1993)
Expression and mutation of soybean β-amylase in Escherichia coli,Eur.J.Biochem.214,787-794(1993)
Residues esserntial for catalyric activity of soybean β-amylase,Eur.J.Biochem.in-press (1994)
Submitted to Plant Mol.Biol.
特許(日本、米国、スウェーデン)
