耐塩性酵母Pichia farinosaが生産するキラー因子の構造
※アーカイブの成果情報は、発表されてから年数が経っており、情報が古くなっております。
同一分野の研究については、なるべく新しい情報を検索ください。
要約
耐塩性酵母Pichia farinosaのキラー因子SMKTはpH5以下では安定であるが、中性pHではサブユニットの解離を伴って失活する。円偏光二色性(CD)による2次構造解析により、pHによるサブユニット構造の変化を明らかにした。さらに共同研究により、1.8Åの分解能でSMKTの結晶構造を明らかにした。
- 担当:食品総合研究所・応用微生物部・糸状菌研究室
- 代表連絡先:0298-38-8077
- 部会名:食品
- 専門:バイテク
- 対象:微生物
- 分類:研究
背景
酵母には蛋白質性のキラー因子を分泌して他の酵母の生育を阻害するキラー現象が知られている。分泌されるキラー因子は非常に多様であり、その構造および作用機作もキラー因子によって全く異なることが近年明らかになってきた。耐塩性酵母Pichia farinosaが生産するキラー因子SMKTは、α,βのサブユニットからなる二量体で、高濃度食塩存在下でより強い活性を示す。SMKTはpH5以下では安定であるが、中性pHではサブユニットが解離し失活する。SMKTのpHによるサブユニット構造の変化を明らかにするため、CDによる二次構造の解析を行った。さらにpH依存性のユニークな構造を明らかにするため、X線による結晶構造解析を行った。
成果の内容・特徴
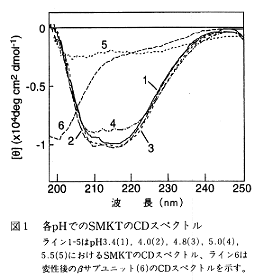
- pH3.5-5.0では190-250nmにおけるCDスペクトルに変化はなく、一定の二次構造をとることが推定される。pH5.5ではサブユニットは解離し、疎水性の高いαサブユニットが凝集した。この結果はpH5.0からpH5.5の間で急激な構造変化が起こることを示唆している(図1、Lines 1-5)。
- 中性溶液中、αサブユニットから解離したβサブユニットは特徴的な二次構造を持たず、ランダムコイルとして存在することが明らかになった。この結果はSMKTが両サブユニット間の結合を介して高次構造を保持していることを示している(図1、Line 6)。
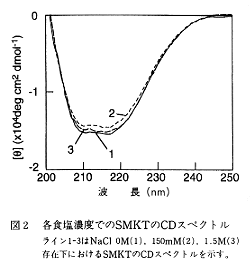
- 1.5M食塩存在下のSMKTのCDスペクトルは食塩非存在下のものと差がないことから、SMKTの食塩濃度に依存した活性発現は、蛋白質の構造変化によるものではなく、感受性酵母の感受性が食塩により増大するものと推定された(図2)。
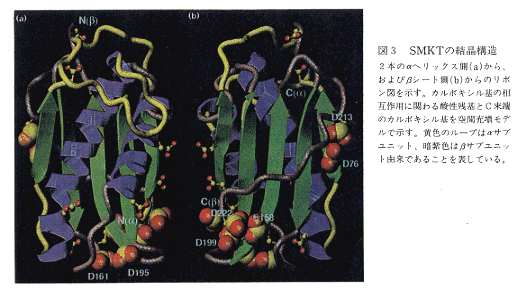
- SMKTの結晶構造は1.8Åの解像度で決定された。SMKTはα,βの両サブユニットが共同してフォールドし、全体として単一ドメインからなる楕円体型の球状蛋白質を形成している。α,βサブユニットが共に形成する5本鎖逆平行βシートの片面に、α,βサブユニットそれぞれが形成する2本のαヘリックスがほぼ逆平行に並んで配置したα-βサンドイッチ構造をとっている。アスパラギン酸残基などカルボキシル基間の相互作用が構造の安定化に寄与しており、これが構造のpH依存性と大きく関わるものと推測された(図3)。
- 植物病原菌Ustilago maydisの生産するキラー因子KP4はサブユニット構造はとらず単一のポリペプチドからなり、SMKTとの間にアミノ酸配列の相同性は全く認められないにも関わらず、両者の結晶構造とほとんど同じ折れたたみ方をしていることが明らかとなった。
成果の活用面・留意点
KP4はRNAプラスミドにコードされており、染色体にコードされるSMKTとは遺伝子の構造も異なるが、同じ形の分子として機能する点で非常に興味深い。KP4との機能の類似性も考慮しつつ、今後はSMKTが認識する分子について解析を行う。
具体的データ
その他
- 研究課題名:耐塩性キラー酵母のキラー活性発現機構の解明
- 予算区分:経常
- 研究期間:平成8年度(平成6年~8年)
- 研究担当者:鈴木チセ、新国佐幸、柏木立己、国島直樹、森川耿右(生物分子工学研究所)、土屋文彦、荒田洋治(機能水研究所)
- 発表論文等:Circular dichroism analysis of the interaction between the α and β subunits in a killer toxin produced by a halotolerant yeast, Pichia farinosa. Protein Engineering, vol.10, No.2, 99-101 (1997).
The novel acidophillic structure of the killer toxin from halotolerant yeast demonstrates remarkable folding similarity with a fungal killer toxin. Structure, vol.5, No.1, 81-94 (1997).
