酵素機能の増幅に有用なタンパク質修飾法の開発
※アーカイブの成果情報は、発表されてから年数が経っており、情報が古くなっております。
同一分野の研究については、なるべく新しい情報を検索ください。
要約
糸状菌のα-アミラーゼをオルトフタルアルデヒドにより化学修飾し、性質の改変を試みた。修飾酵素では最適pHが変化し、生成物のグルコース量が増大した。
- 担当:食品総合研究所・食品理化学部・炭水化物研究室
- 代表連絡先:0298-38-8132
- 部会名:食品
- 専門:バイテク
- 対象:工芸作物類
- 分類:研究
背景
本研究では代表的な微生物起源のα-アミラーゼであるタカアミラーゼA(N-TAA)を用いて化学修飾を行い、酵素化学的な諸性質の改変を試みた。修飾剤としてアミノ基の蛍光定量に使われるオルトフタルアルデヒド(OPA)を用い、既報に従って修飾酵素(M-TAA)を調製した。N-TAA は可溶性デンプンを基質とした場合にマルトースマルトトリオースが主成物となるが、M-TAAでは酵素反応の最適pHの酸性側へのシフトが認められ、生成物としてグdルコースの量が著しく増加するなどの明白な性質の変化が得られた。
成果の内容・特徴
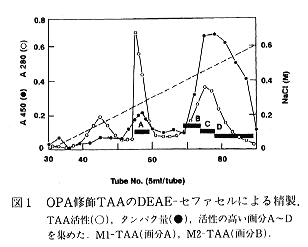
- OPAで修飾したM-TAAはカラムクロマトグラフィーで精製し、M1-TAA(画分A)とM2-TAA(画分B)の2成分に分画された(図1)。
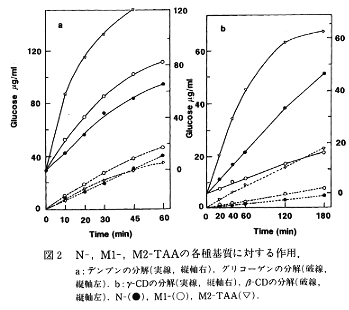
- 可溶性デンプン、グリコーゲン、サイクロデキストリン(CD)に対する作用を比較した結果、M2-TAAは可溶性デンプンに対する作用性が数倍に増加し、M1-TAAでも向上が認められた。M2-TAAはβ-、γ-CDに対する作用もN-TAAより遥かに良好であった(図2)。
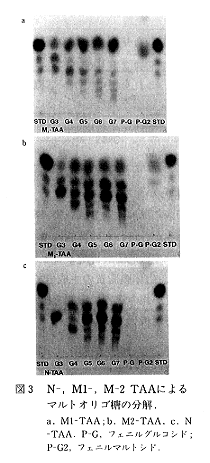
- マルトオリゴ糖に対する作用をN-TAA、M1-、M2-TAAで比較したところ、N-TAAではG3~G7からG2、G3が多く生成するのに対して、M1-TAAではグルコース生成量が多く、G2は残りにいことがわかった。また、M2-TAAではN-TAAに近い生成物比を与えたが、グルコースが多く生成する点で独自の作用性を示した(図3;STD:標準糖(グルコース、マルトース、マルトトリオース))。
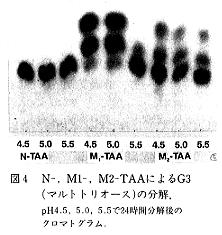
- G3の分解性をpH 4.5、5.0、5.5で比較した。N-TAAはG3をほとんど分解できなかったが、M-TAAはG3を良好に分解し、しかも、より酸性側のpH4.5で高い分解性を示した(図4)。
成果の活用面・留意点
N-TAAのアミノ基をOPAで修飾することにより、酵素の性質が著しく変化することが明らかになった。この手法を遺伝子工学の手法と組み合わせることによって、N-TAAと特異性の異なるM-TAAを生産することも可能となった。OPA の疎水性が、今回得られた酵素化学的な性質の変化を規定していると推定されるため、この点をどう解決するかが重要と考えられる。
具体的データ
その他
- 研究課題名:酵素機能の増幅に有用なタンパク質工学的手法の開発
- 予算区分:経常
- 研究期間:平成8年度(平成5~8年)
- 研究担当者:小林幹彦
- 発表論文等:M. Kobayashi, M. Miura, T. Watanabe, and E. Ichishima: Arch. Biochem. Biophys., 289(2), 350-354 (1991).
M. Kobayashi, M. Miura, and E. Ichishima: Biochem. Biophys. Res. Commun., 183(1), 321-326 (1992).
H. Ueyama, Y. Chiba, and M. Kobayashi: Biosci. Biotech. Biochem., 59(5), 864-868 (1995).
M. Kobayashi, H. Ueyama M. Miura and E. Ichishima: Oyo Toshitsu Kagaku, 43(1), 51-58 (1996).
