タンパク質の高次構造形成を触媒する酵素
※アーカイブの成果情報は、発表されてから年数が経っており、情報が古くなっております。
同一分野の研究については、なるべく新しい情報を検索ください。
要約
タンパク質はその機能を発現するには正しい高次構造をとることが必要である。このような高次構造形成を触媒する酵素,プロテインジスルフィドイソメラーゼを単離しその特性を明らかにした。
- 担当:食品総合研究所・食品理化学部・蛋白質研究室
- 代表連絡先:0298-38-8051
- 部会名食品:
- 専門:バイテク
- 対象:蛋白質一般
- 分類:研究
背景
細胞内では,タンパク質の生合成後,秒あるいは分単位で本来の高次構造形成が達成されるがその詳細な機構ついては明らかではない。又,遺伝子工学的に生産された組み換えタンパク質は本来のS-S結合が形成できず,不溶体となったり,不活性型になる場合が多い。Protein Disulfide Isomerae(PDI)はS-S結合を掛け換えることで未成熟あるいは変性タンパク質の高次構造と機能を回復させる酵素であり,その機能の解明は重要である。
成果の内容・特徴
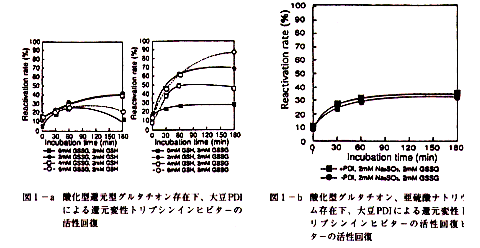
- 大豆PDIの存在下,還元変性トリプシンインヒビター(BBTI)のさまざまな酸化還元状態で,トリプシン阻害活性の回復を検討した結果,活性回復にはSH基およびSS結合の依存が必須であり,その平衡は還元型に偏っていた(図1-a,b)。
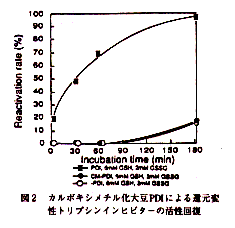
- グルタチオン酸化還元緩衝液中,大豆PDIの非存在下では180分で10%のトリプシン阻害活性が回復したのみであったが,PDI存在下ではほぼ100%のトリプシン阻害活性が回復し,還元変性BBTIの構造再生にはSH基を介した酸化還元が必須であった(図-2)。
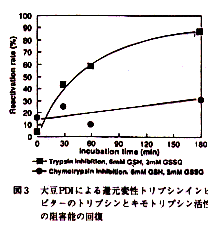
- しかし,同条件下においてキモトリプシン阻害活性はPDI存在下でも30%程度の回復しか認められなかった(図-3)。この差は両活性ドメインの立体構造の再生の違いに起因するものと考えられた。
成果の活用面・留意点
遺伝子組み換えにより生産された有用蛋白質は、目的とする性質や機能を示さない場合が多いが、その原因は大半が高次構造形成不全のためである。本PDIの同時発現や分離後PDIを作用させることによって機能タンパク質を得る方策を開発することが可能となる。
具体的データ
その他
- 研究課題名:蛋白質の高次構造形成と機能の解明
- 予算区分:フロンティア
- 研究期間:平成9年度(平成8年~10年)
- 研究担当者:大倉哲也、河村幸雄
- 発表論文等:K.Kainuma,T.Ookra, A.Okamoto, K.Kitta,M.Manabe.and Y.Kawamura: Protein disulfide isomerase activity of some plant seeds, Biosci. Biotec. Biochem. 62 369-371 (1998)
Y.Kawamura,T.Ookura, and K.Kainuma:Protein dislfide isomerase from soybean;Isolation, Structure, and Fnction in Protein Folding, In Prolyl Hydroxylase,Protein DisulfideIsomerase, and Other Structurally Related Proteins, ed. by N.A.Guzman, (1997), Marcel Dekker, New York,Basel,Hong Kong.pr:149-171
T.Ookra,K.Kainuma, H-J Kim, A.Otaka, N.Fujii and K. Kawamura: Active side pepti-des with CXXC motif on MAP-Resin can mimic protein disulfide isomerase activity,Biochem. Biophys. Res. Commun. 213(3) 746-751(1995)
K.Kainuma,T.Ookura, and Y.Kawamura: Purification and characterization of proteindisulfide isomerase from soybean, J. Biochem. 117 208-215(1995)
