α-ガラクトシダーゼの基質認識機構
※アーカイブの成果情報は、発表されてから年数が経っており、情報が古くなっております。
同一分野の研究については、なるべく新しい情報を検索ください。
要約
イネのα-ガラクトシダーゼを培養細胞濾液からアフィニティークロマトグラフィーを用いて精製し、50%の収率で35mgの精製酵素を得た。本酵素は、ガラクトマンノオリゴ糖の直鎖状及び側鎖状のガラクトース残基に同程度に作用することを明らかにした。
- 担当:食品総合研究所・生物機能開発部・分子情報解析研究室
- 代表連絡先:0298-38-8063
- 部会名:食品
- 専門:バイテク
- 対象:稲類
- 分類:研究
背景
α-ガラクトシダーゼは糖脂質や多糖、オリゴ糖等からガラクトースを遊離するエキソ型の酵素であり、生物全般に分布している。植物種子においては発芽時のエネルギー確保のために、また動物においては糖脂質の代謝などの役割を担っており、ヒトにおいては本酵素活性の欠損による遺伝病であるファブリー病が知られている。また、微生物由来の酵素は精糖工程において利用されているため、工業的にも重要な酵素である。今までに糸状菌Mortierella vinaceaとPenicillium purpurogenumのα-ガラクトシダーゼの一次構造を明らかにしたが、結晶化がうまくゆかず高次構造に関しては殆ど情報がない状態である。本研究では、立体構造解明のための単結晶を得るためにイネα-ガラクトシダーゼを精製し、その性質を検討した。
成果の内容・特徴
- イネ細胞培養液からe-aminocaproyl-a-D-galactopyranosylamineをリガンドとするアフィニティークロマトでα-ガラクトシダーゼを精製した。14リッターの培養液から35mgの精製酵素が得られた。
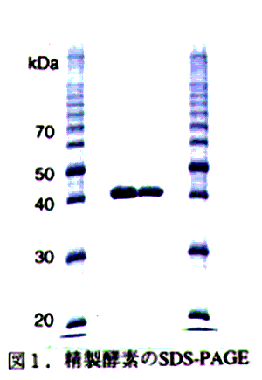
- 精製酵素はSDS-PAGEで単一のタンパク質バンドを与え、その大きさは42kDaであった(図1)。また、レクチンとの反応性からN-型糖鎖は持たないものと考えられた。本酵素のN-末端アミノ酸配列を決定したところ、コーヒーのα-ガラクトシダーゼと78%の相同性を示した(図2)。
- 精製酵素は、Mortierella vinaceaのα-ガラクトシダーゼIIやコーヒー豆のα-ガラクトシダーゼと同様に、ガラクトマンノオリゴ糖の直鎖状及び側鎖状のガラクトース残基に共に作用することが明らかになった(図3)。
成果の活用面・留意点
現在、イネα-ガラクトシダーゼの結晶化を行っているが、まだ結晶生成条件が確定していない。本酵素は糖鎖がないというメリットと共に、高濃度にすると沈殿しやすいというデメリットも持っており結晶化条件の設定がポイントである。
具体的データ


その他
- 研究課題名:α-ガラクトシダーゼの基質認識機構の解明
- 予算区分:バイテク(糖質工学)
- 研究期間:平成10年度(平成8~12年)
- 研究担当者:小林秀行
- 発表論文等:1)イネα-ガラクトシダーゼの精製と性質、日本農芸化学会1998年度大会、講演要集、p.142(1998).
2)Purification and characterization of alpha-galactosidases from rice.Plant Biology '97. Supplement to Plant Physiology, 114(3), 145(1997).
3)Purification, characterization, and cDNA cloning of a novel a-galactosidase from Mortierella vinacea. Biosci. Biotech. Biochem., 61(4), 592-598(1997).
4)Cloning and high-level expression of a-galactosidase cDNA from Penicillium purputogenum. Appl. Environ. Microbiol., 64(11), 4489-4494(1998).
