アフラトキシンの生合成に関与するO-methyltransferase I の精製と性質検討
※アーカイブの成果情報は、発表されてから年数が経っており、情報が古くなっております。
同一分野の研究については、なるべく新しい情報を検索ください。
要約
アフラトキシン生合成に関与する酵素O-methyltransferase Iを精製し、その性質の検討をした。また、同酵素がDemethylsterigmatocystin からSterigmatocystin 及びDihydrodemethylsterigmatocystin から Dihydrosterigmatocystin へ進む両反応に関与することを明らかにした。
- 担当:家畜衛生試験場飼料安全性研究部がん原性研究室
- 連絡先:0298(38)7824
- 部会名:家畜衛生
- 専門:診断予防
- 対象:共通
- 分類:研究
背景・ねらい
アフラトキシンはAspergillusflavus及びA. parasiticusに属する一部のカビが生産する二次代謝産物であり、自然界でもっとも強力な発ガン性を持つ物質として恐れられている。穀物のアフラトキシン汚染を防御するためには、カビによるアフラトキシン生合成機構を明らかにすることが重要である。そこで生合成経路の詳細について検討し、その結果、カビの生産する四種のアフラトキシンのうち、AFB1,AFG1はDemethylsterigmatocystin (DMST)から、AFB2,AFG2はDihydrodemethylsterigmatocystin (DHDMST)からそれぞれ独立した経路で合成されること明らかにしてきた。本研究では、DMSTからSterigmatocystin (ST)へ進む反応を触媒するO-methyltransferaseIについて、精製を行い、この酵素の性質を検討することによって、同酵素がDHDMSTからDihydrosterigmatocystin (DHST)へ進む反応も触媒する事を明らかにした。
成果の内容・特徴
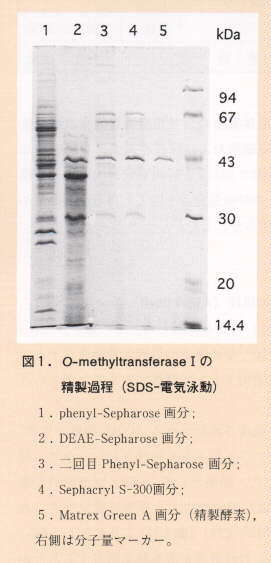
- アフラトキシンは生産できないが、アフラトキシン生合成に関与する種々の酵素は誘導できるA. parasiticus変異株を大量培養した。この株から可溶性画分を調製し、5段階のカラムクロマトグラフィー(phenyl-Sepharose, DEAE-Sepharose, 2nd phenyl-Sepharose, Sephacryl S-300, Matrex Gel Green A)を行うことによって、目的の酵素を単一バンドにまで精製できた(図1)。
- 精製O-methyltransferaseI酵素は、SDS-polyacrylamide gel electrophoresisで42 kDaの単一蛋白であり、Sephacryl S-300 gel-filtration chromatographyでは約150 kDaの単一ピークを示した。酵素活性のpH依存性実験ではpH 6.5からpH 9.0の広い範囲で高い活性を示した。また、調整用等電点電気泳動装置Rotofor Cellで測定した結果、酵素活性の等電点はpH 4.4であった。
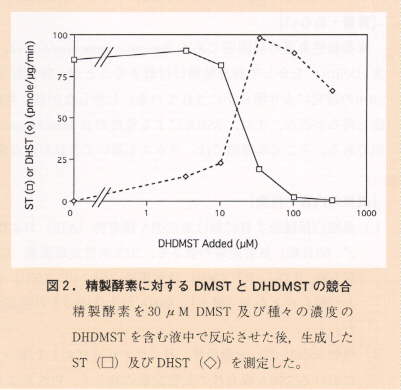
- 精製酵素に基質としてDHDMSTを加えるとDHSTが生成された。さらに精製酵素に対するDMSTとDHDMSTの競合実験(図2)の結果、同一の酵素がDMSTからSTとDHDMSTからDHSTに進む二種の反応を共通に触媒する事を明らかにした。
成果の活用面・留意点
精製酵素の部分的アミノ酸配列を決定することにより、この酵素の遺伝子の単離や構造解析が可能となる。さらに、遺伝子プローブや酵素の抗体作成によって、アフラトキシン生合成機構の詳細な研究の端緒となる。
具体的データ
その他
- 研究課題名:アフラトキシン産生の発現誘導機構
- 予算区分:大型別枠
- 研究期間:平成6年度~平成9年度
- 発表論文等:
- 第42回マイコトキシン研究会, (1996)
- 家畜生化学,33:19-24(1996)
