異常プリオン蛋白質を分解する新規酵素
※アーカイブの成果情報は、発表されてから年数が経っており、情報が古くなっております。
同一分野の研究については、なるべく新しい情報を検索ください。
要約
異常プリオン蛋白質を分解する酵素産生菌を探索するため、候補菌株の培養上清をウエスタンブロッティング法により調べた結果、バチルス属において分解能が高い1株を見いだした。
- キーワード:異常プリオン、蛋白質分解酵素、バチルス・リケニフォルミス
- 担当:動衛研・プリオン病研究センター・安全性技術開発研究チーム
- 連絡先:電話029-838-7840
- 区分:動物衛生
- 分類:技術・参考
背景・ねらい
牛海綿状脳症(BSE)やスクレイピーなどプリオン病の原因蛋白質である異常プリオン蛋白質は通常のオートクレーブ処理や消毒薬に対して極めて強い抵抗性を示す。そのため、牛の屠畜処理器具やヒトの医療分野における高額検査機器などに対して応用が可能な異常プリオン蛋白質の不活化法の確立が求められている。本研究では、安全かつ簡便な不活化法への応用のために、異常プリオン蛋白質分解活性をもつ酵素を検索した。
成果の内容・特徴
- 難分解性タンパク質であるケラチンとアズール色素との化合物に対する分解活性を指標として第一段階のスクリーニングを行い、ストレプトマイセス属10株およびバチルス属12株を選別した。
- 異常プリオン蛋白質の分解活性を調べるため、上記菌株の濃縮培養上清、またはプロテイナーゼK(PK、50μg/ml)とスクレイピー帯広株感染マウス1%脳ホモジネートを等量混合し、37℃で1時間処理した。ポリアクリルアミドゲル電気泳動で分離後、ウサギ抗プリオン蛋白質(PrP)ペプチド抗体を用いてウエスタンブロッティング法により残存する異常プリオン蛋白質の検出を行った。その結果、バチルス属において分解能が高い1株(MSK-103)を見いだした(図1)。MSK-103菌株の培養上清を作用させると、ウエスタンブロッティング法ではバンドは確認されず、この上清中に含まれる酵素により異常プリオン蛋白質が分解されたことが示された。
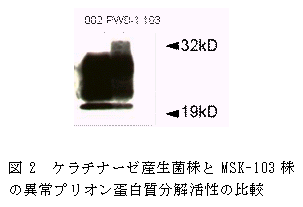
- 難分解性蛋白質分解活性を有する既知のプロテアーゼ(PWD-1およびMSK-002菌株由来のケラチナーゼ)とMSK-103の異常プリオン蛋白質分解活性を比較したところ、MSK-103株由来の酵素は他のケラチナーゼに比べて高い異常プリオン蛋白質分解活性を示した(図2)。MSK-103菌株から酵素を精製し、分子量、等電点、至適pHなどの生化学的特性について分析を行った結果、MSK-103菌株由来の酵素の諸特性は上記ケラチナーゼとは異なっていた。本酵素は異常プリオン蛋白質を分解する新規酵素である可能性が示された。
成果の活用面・留意点
MSK-103菌株の異常プリオン蛋白質を分解する酵素の生産能は高く、本菌株の培養上清を用いることにより、汚染器具などの消毒に応用できる可能性がある。そのためには、バイオアッセイによる異常プリオン蛋白質の不活化の確認が必要である。
具体的データ

その他
- 研究課題名:異常プリオン蛋白質分解活性を有する酵素生産菌株の探索
- 予算区分:交付金(共同研究)
- 研究期間:2002年度
- 研究担当者:村山裕一、吉岡 都、三浦克洋、三輪岳宏(明治製菓)、黒川 知(明治製菓)、西沢耕治(明治製菓)
- 発表論文等:三輪ら 特許出願中(特願 2002-309248)「難分解性タンパク質を分解する新規なプロテアーゼ」
