プリオン蛋白質の内部構造の安定性とBSE感受性との関連性
要約
牛海綿状脳症(BSE)に対する宿主の感受性および抵抗性の違いは、プリオン蛋白質の内部構造のうちα1-α2およびα2-L4の安定性が影響することをフラグメント分子軌道(FMO)法により明らかにした。実験科学では検証できなかった蛋白質の局所の構造安定性と異常化の関連を明らかにした。
- キーワード:プリオン蛋白質、構造安定性、局所構造、牛海綿状脳症(BSE)、抵抗性
- 担当:家畜疾病防除・プリオン病
- 代表連絡先:電話 029-838-7708(情報広報課)
- 研究所名:動物衛生研究所・プリオン病研究センター
- 分類:研究成果情報
背景・ねらい
プリオンの異種動物への伝達性には種の壁に伴う、感受性の差が知られている。この差は動物種ごとのプリオン蛋白質(PrP)の構造の違いに起因すると考えられている。しかし、これまでに報告されている核磁気共鳴(NMR)を用いた実験科学的なPrPの構造解析では各動物種間のPrPに明瞭な差は認められていない。
そこで、コンピューターシミュレーションの一手法であるフラグメント分子軌道(FMO)法を用いて、分子内の相互作用を指標にPrPの構造安定性を評価する。牛海綿状脳症(BSE)の感受性動物(牛、マウス、ネコ、ヒト)と抵抗性動物(イヌ、ハムスター)のPrPをFMO法で解析し、BSEに対する宿主の感受性とPrPの局所構造、局所の構造安定性との関係を明らかにする。
成果の内容・特徴
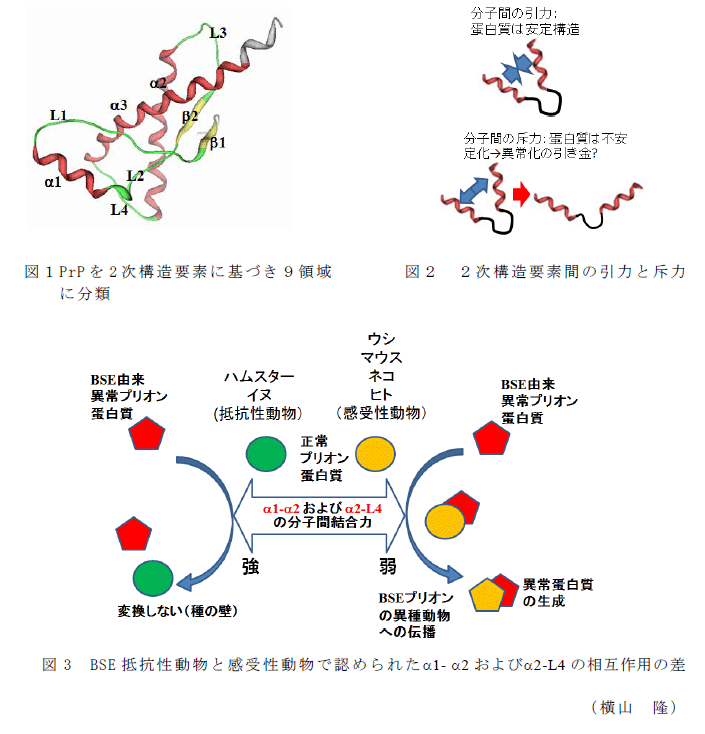
- PrPの分子内の相互作用は、2次構造要素に基づいた9領域(αへリックス:α1~α3、βシート:β1~β2、ループ領域:L1~L4)(図1)について、各要素間の分子間力を理論計算する。
- BSE感受性動物と抵抗性動物のPrPの内部構造の安定性の比較から、α1-α2およびα2-L4間に引力が働く内部構造を持つハムスター・イヌのプリオン蛋白質は安定で変換されにくく、斥力が働く内部構造を持つウシ・マウス・ネコ・ヒトのプリオン蛋白質は不安定で変換されやすいと考えられる(図2、図3)。
成果の活用面・留意点
- 蛋白質の外部構造の比較では認められなかった蛋白質の内部構造の安定性を評価する手法を開発した。
- 実験科学では検証できなかった蛋白質の局所構造、局所の構造安定性と蛋白質の異常化について提唱し、実験科学と構造シミュレーションの融合した新たな研究領域を開拓した。
具体的データ
その他
- 中課題名:プリオンの異常化機構の解明とBSE等のプリオン病の清浄化技術の開発
- 中課題番号:170b2
- 予算区分:委託プロ(BSE)
- 研究期間:2008~2012年度
- 研究担当者:横山隆、長谷川浩司(アドバンスソフト)、毛利資郎
- 発表論文等:
1) Hasegawa K. et al. (2010) Prion 4(1):38-44
2) Hasegawa K. et al. (2013) Prion 7(2):185-191
