卵白オボムコイドのT及びB細胞エピトープ
※アーカイブの成果情報は、発表されてから年数が経っており、情報が古くなっております。
同一分野の研究については、なるべく新しい情報を検索ください。
要約
鶏卵アレルギーの主要原因タンパク質、オボムコイドについて、各種実験動物の抗体が 結合するB細胞エピトープ及びマウス認識T細胞エピトープ領域を、合成部分ペプチドを用いて明らかにした。
- 担当:畜産試験場加工部畜産物利用開発研究室
- 連絡先:0298-38-8687
- 部会名:畜産
- 専門:加工利用
- 対象:採卵鶏
- 分類:研究
背景・ねらい
近年食物アレルギーが大きな健康問題となり、アレルゲンの有効な抗原性低減化方法の開発やアレルゲンに対する免疫応答機構の解明が急がれている。アレルギー発症に至る免疫反応には、T細胞、B細胞及び抗体が重要な役割を果たすことから、上記研究には、これら細胞や抗体に認識されるアレルゲン分子側の構造(エピトープ)に関する基礎知見が不可欠となっている。しかし、主要な食物アレルゲンのエピトープに関する研究は、実験動物を用いた基礎研究さえ十分行われていないのが現状である。従って本研究は、マウスをはじめとする各種実験動物を用いて、卵白アレルゲンタンパク質であるオボムコイド(OM)のエピトープを明らかにすることを目的とした。
成果の内容・特徴
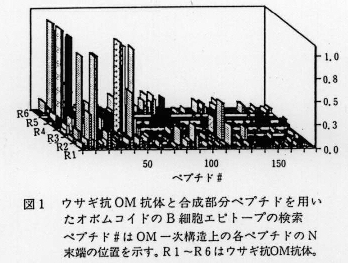
- 抗OM抗体は、ヤギ5頭、ウサギ6羽、近交系マウスの3系統(C3H/He,BALB/c及びC57BL/6)、クローズドコロニー1系統から得た。また抗OMモノクローナル抗体(MAb)17種を得た。これらの抗体とOM分子全域をカバーするように合成した長さ8残基の部分ペプチド179種との反応性をELISAで解析した。一例としてウサギを用いた結果を(図1)に示す。
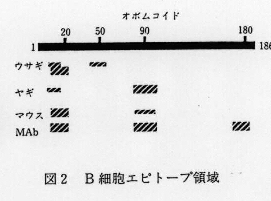
- 得られたB細胞(抗体結合>エピトープ領域のOM一次構造上の位置を(図2)に示す。主要領域は、ヤギでは85-95残基目、ウサギ、マウスでは11-19残基目であった。OMは、従来立体構造依存型のB細胞エピトープを持つとされてきたが、これらの結果により一次構造依存型エピトープも存在することが初めて明らかになった。
- 一方、17種のMAbのうち部分ペプチドと反応したものは4抗体に過ぎなかった。残りは立体構造依存型エピトープ結合性と推測され、OMの抗原構造における立体構造の重要性が改めて認識された。
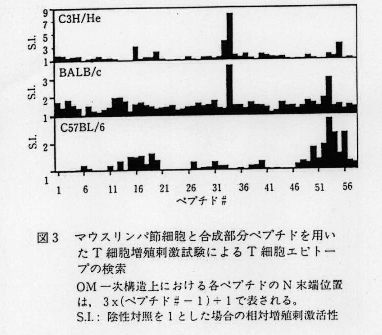
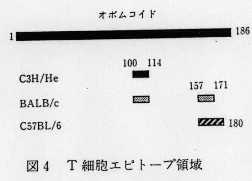
- OM分子全域をカバーするように合成した長さ15残基の部分ペプチド58種を用いてOMに特異的なT細胞増殖刺激活性を持つペプチドを検索し、T細胞エピトープ領域を明らかにした(図3)。主要領域は、C3H/Heでは100-114残基目、BALB/cでは100-114及び15a7-171残基目、及びC57BL/6では157-180(157-171及び166-180)残基目であった(図4)。
成果の活用面・留意点
低抗原性OMの分子設計や経口免疫寛容機構の解析研究は、現状では実験動物系での基礎研究段階であるが、本成果は、その基礎知見として不可欠である。また、本研究で用いた手法・材料は、ヒトIgE抗体レベルにあわせて超高感度化を図ることにより、アレルギー患者血清を用いた研究にも応用可能である。
具体的データ
その他
- 研究課題名:1.食品蛋白質に対する免疫応答機構 2.食物アレルゲンのエピトープ解析
- 予算区分:1.大型別枠(生物情報) 2.科振調(生活・地域)
- 研究期間:平成7年度(1.昭和63~9年度,2.平成5~7年度)
- 発表論文等:
1)Mapping of sequential epitopes on ovomcoid,an egg allergen.Proceeding of UJNR protein Resources Panel,24th Annual Meeting,p31~35(1995)
2)ピン・ペプチドを用いた卵白オボムコイドのエピトープ解析.第89回日本畜産学会大会講演要旨, p29(1994)
3)ニワトリオボムコイドのT・B細胞エピトープの解析.1994年度日本農芸化学会大会講演要旨,日本農芸化学会誌,68(3), p159(1994)
