産卵鶏肝臓と腎臓および牛肝臓におけるアスパラギン酸アミノトランスフェラーゼの分子内糖鎖の比較
※アーカイブの成果情報は、発表されてから年数が経っており、情報が古くなっております。
同一分野の研究については、なるべく新しい情報を検索ください。
要約
産卵鶏肝臓と腎臓および牛肝臓AspATの分子内糖鎖の大きさと数は動物種,臓器および細胞内局在性によって異なる。
- 担当:畜産試験場 生理部 上席研究官
- 連絡先:0287-38-8648
- 部会名:畜産
- 専門:生理
- 対象:家畜類
- 分類:研究
背景・ねらい
家畜の各種臓器に存在するアスパラギン酸アミノトランスフェラーゼ(Aspartateaminotransferase,EC2.6.1.1) (AspAT)については分子内糖鎖の存在が示唆されているが、各臓器におけるその糖鎖構造および酵素機能との関連性はほとんど分かっていない。それゆ え、産卵鶏の肝臓と腎臓および牛肝臓の細胞質由来AspAT(cAspAT)とミトコンドリア画分由来AspAT(mAspAT)の分子内糖鎖の大きさと 量および酵素機能との関連性を比較検討した。
成果の内容・特徴
- 高い産卵率を維持している白色レグホーン種産卵鶏の肝臓と腎臓およびホルスタイン種雄牛の肝臓から細胞質およびミトコンドリア画分のアスパラギン 酸アミノトランスフェラーゼ(cAspATとmAspAT)を抽出後、硫安塩析、ゲル濾過、各種イオン交換クロマトグラフィー、等電点電気泳動法などの組 み合わせによっておのおのの分子種をSDS‐PACEで単一のバンドと判定されるまで精製した。
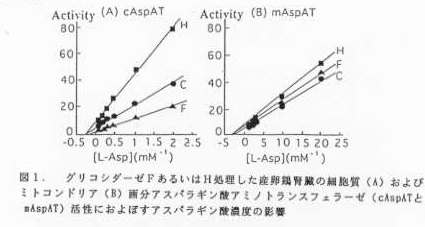
- 分子内糖鎖の機能を知るため、cAspATとmAspATにグリコシダーゼFおよび/あるいはH処理を行い、酵素活性や酵素に対する親 和性(Km値)とVmaxについて検討した結果、AsPATの分子種によってグリコシダーゼFとH処理の効果が異なった。また、cAspATと mAsPATの各分子種で共にグリコシダーゼ処理によりKm値よりもVmaxが顕著な影響を受けることが明らかになった(図1) 。
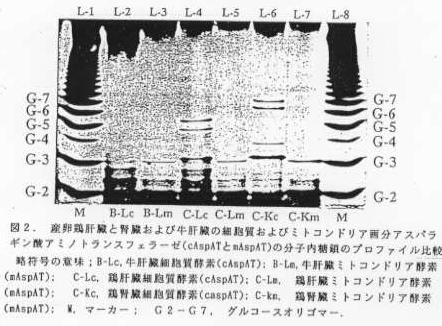
- 鶏肝臓、鶏腎臓や牛肝臓のcAspATとmAspATからN‐結合型糖鎖切り出し酵素PNG‐Fで切り出した粗鎖を蛍光色素ANTSで 標識して電気泳動を行うと、臓器の種類および細胞質あるいはミトコンドリア画分のような細胞内局在性に特異的な糖鎖のプロファイルが認められた。特に、電 気泳動図のバンドの位置と数から、cAspATのN‐結合型糖鎖の数や量は臓器によっておのおの顕著に異なったのに対しmAspATでは糖鎖の構成単位に 関してあまり差がなかった(図2) 。
成果の活用面・留意点
-
産卵鶏の肝臓や腎臓および牛肝臓のcAspATとmAspATにN‐結合型糖鎖が存在することが明らかになり、分子内糖鎖の大きさや数はAspAT分子の
種類や由来を推定する指標となる。しかし、これらの酵素分子の糖鎖が家畜のいろいろな生理状態に対応してどのように変動し、酵素分子の機能発現の制御機構
にどのように関与しているかについての詳細な検討が残されている。
具体的データ
その他
- 研究課題名:家畜の代謝調節におけるアミノ基転移酵素の分子内糖鎖の機能解明
- 予算区分:バイテク(糖質工学)
- 研究期間 :平成8年度(平成3年~8年度)
- 発表論文等:1)Jpn, J. Electroph,40,p111-117(1996) [Transaminase function and
intramolecular sugar chain]
2)1996年度日本家禽学会春季大会講演要旨,p7(1996)
3)第91回日本畜産学会大会学会講演要旨,p.246(1996)
