食肉熟成中の筋肉タンパク質コネクチンの変化と構造
※アーカイブの成果情報は、発表されてから年数が経っており、情報が古くなっております。
同一分野の研究については、なるべく新しい情報を検索ください。
要約
食肉の熟成中に起るコネクチンの開裂を免疫組織化学的に解析し,筋原線維内での開裂部位を明らかにした。また,コネクチン分子の1次構造が家畜種,筋肉のタイプによって異なることを明らかにした。
- 担当:畜産試験場 加工部 食肉特性研究室
- 連絡先:0287-38-8686
- 部会名:畜産
- 専門:加工利用
- 対象:乳用牛
- 分類:研究
背景・ねらい
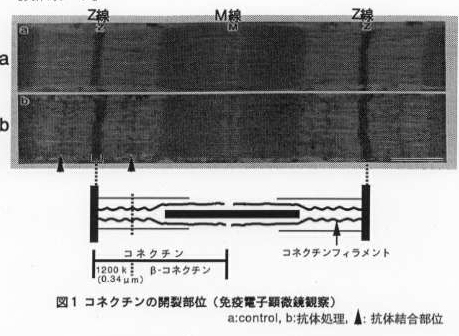
骨格筋の細胞骨格タンパク質であるコネクチンは分子量約300万の巨大タンパク質で,筋肉を構成する最小単位の筋原線維内に存在している。コネクチン分子 は1分子で筋原線維のZ線からM線に渡る長さ(約1.2μm)を有しており,筋原線維内の弾性線維であるコネクチンフィラメントを構成している (図1) 。 コネクチンは食肉の品質としての弾性に関与していることが示唆され,その構造や食肉熟成中の変化が各食肉の品質に影響していると考えられる。そこで本研究 では,食肉熟成中におけるコネクチンの変化を解析するとともに,コネクチン分子の1次構造が家畜種と筋肉のタイプによって異なることを明らかにすることを 目的とした。
成果の内容・特徴
- 食肉の熟成中にコネクチン分子は、分子量約120万のペプチド(1,200kDaサブフラグメント)とその他の部分のペプチド(β一コネクチン) に開裂した。1,200kDaサブフラグメントに対する抗体を作成し,同ペブチドがコネクチン由来であることを免疫学的に確認した。さらに作成した抗体を 用いた間接免疫蛍光法と免疫電子顕微鏡法により1,200kDaサブフラグメントの筋原線維内での局在を観察した。その結果,コネクチン分子のZ線側の端 の部分が1,200kDaサブフラグメントで構成されていること,食肉熟成中のコネクチンの開裂がZ線から約0.34μmの部位で起こることを明らかにし た(図1)。
- 電気泳動法により,家畜種(ウシ,ブタ,ニワトリ)によってコネクチンの分子量が 異なること,ペプチドマッピング法によって,筋肉のタイプによってコネクチンの1次構 造が異なることを明らかにした。さらに,PCR法を用いたダイレクトシークエンス法 によりコネクチン遺伝子の部分配列を決定し,家畜種によってコネクチンのアミノ酸配 列が異なることを明らかにした(図2)。
成果の活用面・留意点
食肉熟成中のコネクチンの変化を免疫組織化学的に解析することができた。本研究で明 らかにしだコネクチンの開裂が,熟成中の食肉の弾性喪失を引き起こしていると考えられ る。さらに,コネクチンの1次構造が家畜種や筋肉のタイプによって異なることから,こ れらの構造の違いが各食肉の品質の違いに関与していることが示唆された。
具体的データ

その他
- 研究課題名:筋肉タンパク質の構造と性状
- 予算区分:経常
- 研究期間:平成8年度(平成4~8年度)
- 研究担当者:田邊亮一,室谷 進,千国幸一-->
- 発表輪文等:1)Postmortem changes in skeletal muscle connectin.Proceedings of
38th lnternational Congress of Meat Science and Technology,
Clermont-Ferrand,France,vol.3,p427-430(1992)
2)Purification and characterization of the 1,200-kDa
subfragment of connectin filaments produced by 0.1mM calcium ions.
J.Biochem.,115,p351-355(1994)
3)Skeletal muscle connectin primary structures as related to
animal species and muscle type.J.Food Sci.,62(1997)(in press)
