血清飢餓培養した体細胞ミトコンドリアの注入はウシ卵子の発生率を低下させる
※アーカイブの成果情報は、発表されてから年数が経っており、情報が古くなっております。
同一分野の研究については、なるべく新しい情報を検索ください。
要約
7日間血清飢餓培養を行ったウシ線維芽細胞より精製したミトコンドリアは、MII期のウシ卵子へ顕微注入することにより、単為発生能を低下させる。同様に、マウス線維芽細胞より精製したミトコンドリアの顕微注入は、マウス卵子の単為発生能を低下させる。
- キーワード:核移植、肉用牛・乳用牛、マウス、ミトコンドリア、家畜育種繁殖
- 担当:畜産草地研・高度繁殖技術研究チーム
- 代表連絡先:電話029-838-8624
- 区分:畜産草地
- 分類:研究・参考
背景・ねらい
家畜のクローン胚作成には核移植技術が用いられているが、ウシの場合、体細胞を除核した卵子に融合するため、体細胞核とともにミトコンドリアも卵子内に持ち込まれる。しかし、卵子内のミトコンドリアは体細胞のミトコンドリアとは異なる形状であることが知られており、体細胞のミトコンドリアが核移植胚の発生に影響を与える可能性がある。また、核移植に用いるドナー細胞の処理として血清飢餓培養を通常行うが、血清飢餓培養によって体細胞のミトコンドリアの形状が変化すると考えられる。本研究は、ウシおよびマウスの単為発生系を用い、血清飢餓処理もしくは無処理の体細胞のミトコンドリアが卵子の発生に与える影響を明らかにし、核移植胚の発生率の向上に寄与することを目的とする。
成果の内容・特徴
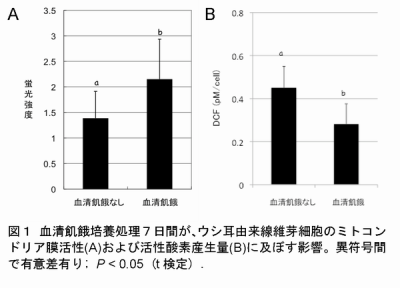
- 体外培養における細胞内ミトコンドリア膜の活性は、細胞種、培養状態、血清飢餓培養によって異なっている。7日間以上0.5%の血清を含むD-MEM培地で血清飢餓処理を行うことによって、その活性は有意に上昇する(図1)。
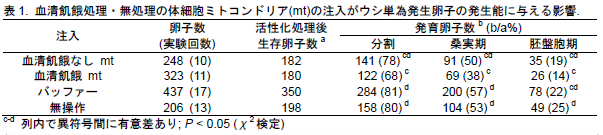
- 7日間の血清飢餓処理を行った黒毛和種雄耳由来線維芽細胞から精製したミトコンドリアをMII期のウシ体外成熟卵子内へ微量注入する(図2)。ついで、その卵子に単為発生を促し、IVD101培養液中で培養すると、胚盤胞期胚への発生率について有意な差とはならないが、分割率および桑実胚への発生率は、バッファーのみを注入した対照区と比較して有意に低くなる(P<0.05)(表1)。この時、注入したミトコンドリアDNA量は、核移植で持ち込まれる量と同程度である。以上のことより、ウシの核移植時に体細胞の血清飢餓培養を7日間以上行うと発生率の低下が懸念される。
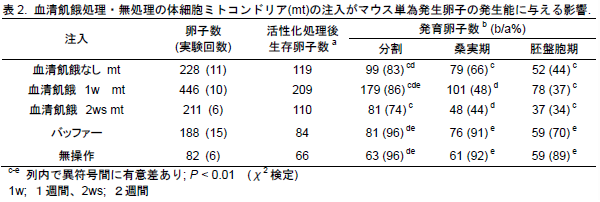
- 血清飢餓処理もしくは無処理のM. spretus系統マウス耳由来線維芽細胞から精製したミトコンドリアをF1マウス(B6D2F1)の未受精卵子に顕微注入し単為発生を促すと、バッファーのみを注入した区と比較して桑実期および胚盤胞期への発生率は有意(P<0.01)に低くなる(表2)。体細胞ミトコンドリアを注入した受精卵についても同様の傾向を示す。以上のことより、マウス核移植時に体細胞ミトコンドリアを持ち込むと発生率の低下が懸念される。
- 3の細胞について血清飢餓培養を1~2週間行い、ついで、精製したミトコンドリアをマウス卵子へ顕微注入すると、血清飢餓を行わなかった場合と比較して桑実胚への発生率は有意に低くなる(P<0.01)(表2)。
- 卵母細胞質(ミトコンドリア含む)の卵子への注入はウシおよびマウス卵子の単為発生を阻害しない(Takeda et al., 2005, 2009)。
成果の活用面・留意点
- ウシ及びマウスの核移植胚の作出効率改善の検討に利用できる。
具体的データ

その他
- 研究課題名:高品質畜産物生産のためのクローン牛等の安定生産技術の開発
- 中課題整理番号:221n
- 予算区分:交付金プロ(クローン牛)、委託プロ(体細胞クローン)
- 研究期間:2002年~2009年度
- 研究担当者:武田久美子、太齊真理子、赤木悟史、松川和嗣(現高知大)、高橋清也、田上貴寛、韮澤圭二郎、Carl A. Pinkert(アーバン大)
- 発表論文等:
1) Takeda K. et al. (2010) Mitochondrion. 10:137-142
2) Takeda K. et al. (2005) Biol. Reprod. 72:1397-1404
3) Takeda K. et al. (2002) Cloning Stem Cells. 4:223-229
