開発の社会的背景
ジャガイモシストセンチュウ(以下Gr)とジャガイモシロシストセンチュウ(以下Gp)の2種は、いずれも海外からの侵入害虫で、バレイショの減収被害を引き起こす重要害虫です。Grは1972年に北海道で初めて確認され、北海道では11,000ヘクタール以上にまで発生が拡大しており、これを食い止めることが急務となっています。Gpは2015年に北海道で初確認されましたが、まん延を防ぐために植物防疫法に基づいて緊急防除が行われています(以下、2種をまとめてジャガイモシストセンチュウ類、または本センチュウ類と記載します。)。 (図1) 」と呼ばれる状態で土壌中に潜在します。このシストの中には卵が数百個(通常100~400個)内蔵され、バレイショが栽培されていない期間は、多くの卵がふ化せずにシスト内にとどまっています。シストの近くにバレイショが植えつけられ、その根から放出される「ふ化促進物質」の刺激を受けると、幼虫(体長約0.5 mm)が一斉にふ化します。幼虫は、バレイショの根に寄生し、根から養分を吸収しながら成育します。雌成虫は肥大化して根の表面に露出し、雄成虫と交尾します。交尾後の雌成虫は卵を体内に抱え、その体が卵で充満すると一生を終え、体表が硬くなって新たなシストとなります。シストは、収穫作業時に根から容易に離脱して土壌中に残るため、翌年以降の新たな感染源となります。
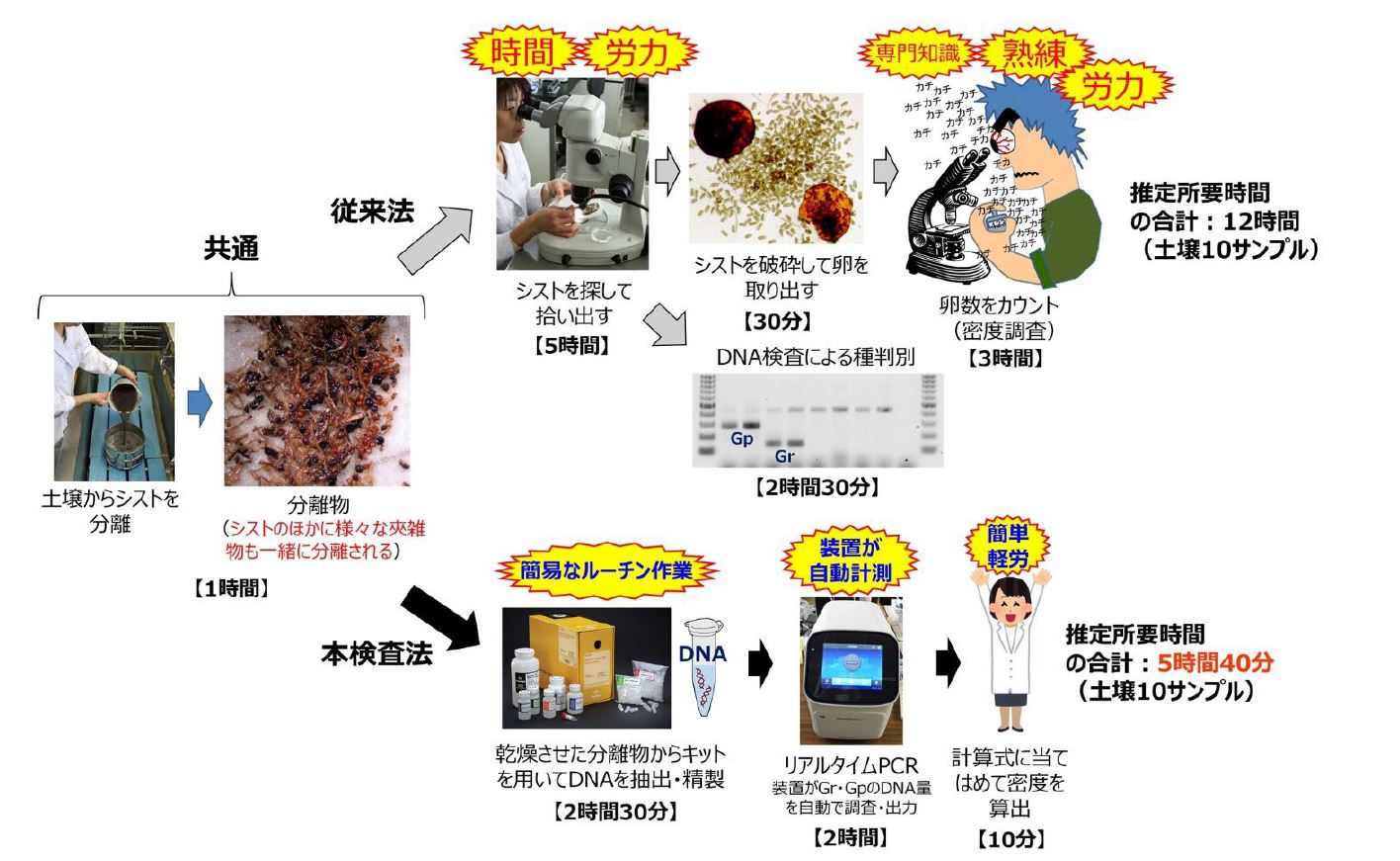
https://sop.naro.go.jp/document/detail/82 )」が活用できます。しかし、従来の検査法は、顕微鏡を用いた調査・作業が主体で、センチュウの形態に関する高度な専門知識と熟練が求められ、時間や労力もかかるため、検査を実施するには大きな負担が伴います(図2) 。このことが本センチュウ類の検査の普及を妨げる大きな要因となっていました。
図1 ジャガイモシストセンチュウ類のシスト(左) シストを壊して内部の卵を露出させた様子(右) 図2 従来の検査法と本検査法の手順の概要
研究の内容・意義
1.開発した検査法の概要
本検査法では、従来法で問題になっていた顕微鏡作業をすべて省き、比較的単純なルーチン作業だけで検査を実施できます。具体的には、従来法と同様に土壌からシストを分離したあと、シストと夾雑物の混合物からセンチュウのDNAを抽出して精製し、リアルタイムPCR装置を使ってセンチュウ種ごとのDNA量を調査します。そのDNA量から規程の計算式を用いることで、本センチュウ類の「発生の有無」、「発生種」、「発生密度」を同時に調査するものです(図2) 。
(図3) 。
2.本検査法の特徴・利点
本検査法では「取り組みやすさ」を追求するとともに、効率的に検査できることを目指しました。
(図2) 。
(図4) 。
3.検査法の活用
本検査法の手順書「リアルタイムPCRによるジャガイモシストセンチュウ類の土壌検診法標準作業手順書」は、農研機構のホームページ上(https://sop.naro.go.jp/document/detail/175 )からダウンロードでき、公的機関や民間の検査機関等の皆さまにご活用いただけます。また、(株)農研植物病院において、土壌中から分離されたシストまたはその類似物について本検査法による検査を行い、本センチュウ類の「発生の有無」、「発生種」を検査するサービスを2025年8月より開始しました(本サービスでは「発生密度」は未対応です)。自ら検査できない場合等にご利用いただけます(https://naroph.jp/business/poteto_pcn.html )。
図3 本検査法によって推定した発生密度と従来法によって調査した発生密度の比較 図4 リアルタイムPCRによる本センチュウ類の検出結果
標準作業手順書・検査サービスの利用方法
■標準作業手順書の利用方法
・以下のURLより、標準作業手順書のサンプル版(PDF)をどなたでもご覧いただけます。 https://sop.naro.go.jp/document/detail/175
■検査サービスの利用方法
・(株)農研植物病院のホームページにある「(株)農研植物病院 ジャガイモシストセンチュウ類(PCN)検査サービスのご案内」をご覧いただき、「注文フォーム」に必要事項をご記入のうえ、お申し込みをお願いします。 https://naroph.jp/business/poteto_pcn.html
今後の予定・期待
本検査法が広く活用されることで、未発生ほ場では本センチュウ類の発生をいち早く把握できます。また、早期に対策することで、その拡大や被害を最小限に抑えることが期待されます。既発生ほ場では発生種や発生密度に応じた的確な防除対策が可能になり、本センチュウ類の効率的な被害回避や封じ込めに繋がることが期待されます。
用語の解説
緊急防除
国内に侵入・発生した病害虫により、農作物等に大きな被害が生じるおそれがある場合に、その病害虫を駆除し、まん延を防止するため、植物防疫法第4章「緊急防除」に基づき、緊急的に実施される防除措置です。Gp の緊急防除では、Gp が確認されたほ場における防除とともに、➀ 寄主植物栽培の制限・禁止、➁病害虫付着のおそれのある植物・容器等の移動制限、およびその廃棄の命令、といった対策が実施されます。
[概要へ戻る]
リアルタイムPCR
DNAポリメラーゼという酵素を使って特定のDNA領域を連鎖的に増幅する反応をポリメラーゼ連鎖反応(PCR)と言いますが、リアルタイムPCRはこのDNA増幅過程でのDNA量を経時的(リアルタイム)に測定する手法です。
[概要へ戻る]
発表論文
Sakata I, Itou K, Kushida A (2024) Efficient quantification of Globodera pallida and G. rostochiensis (Tylenchida: Heteroderidae) in large amounts of soil using probe-based real-time PCR. Applied Entomology and Zoology 59:145-153. https://doi.org/10.1007/s13355-024-00863-y