研究の背景
細菌、特に病原性細菌のゲノムには、他の生物と同様、多くの転移因子(トランスポゾンまたは動く遺伝子)が存在し、多様性を生み出しています。転移因子とは、ゲノム上のある場所から別の場所へ転移(移動)することが可能な塩基配列で、中には薬剤耐性遺伝子などを含む大きなものも存在します。転移因子は転移酵素の働きによって転移しますが、転移因子には、この転移酵素をコードする配列も含まれており、転移因子は自らを転移させる能力を持っていると言えます。
ゲノム上に数多く存在し、頻繁に動く転移因子は、細菌をタイピング(分類)するための指標として有効です。例えば、腸管出血性大腸菌O157ではIS629と呼ばれる転移因子がゲノム上の様々な場所に存在しているため、その数や位置を調べることで、まるで指紋鑑定のようにO157の株を特定することができ、感染症法で規定された伝染病の起因菌であるO157の感染源を迅速に特定するための有効な手段として利用されています(図1)。このような特徴を持つ転移因子については、その転移のメカニズム解明や、転移因子によるタイピング法の他の病原体への適用拡大が期待されています。
研究の経緯
転移因子の転移には、1転移元にオリジナルの分子が残らない「カット&ペースト型」と2オリジナルの複製分子が転移する「コピー&ペースト型」の2種類が知られています。これまで、ほとんどの細菌では、転移因子が抜け落ちた後の細菌のゲノムDNAが修復されず、「カット」すなわちゲノムからの転移因子の切り出しが起こった菌は生存できないため、カット&ペースト型転移はごくまれにしか起こらないと考えられてきました(図2)。しかし、最近、O157では必ずしもそうではなく、カット&ペースト型転移も起こっていることが分かってきました。
私達は、まず、カット&ペースト型転移が起こる効率の指標として「カット」すなわち転移因子の切り出しが起こる効率を測定する方法を開発しました(図3)。そしてどのような遺伝子を持っているかが分かっている様々な大腸菌について、上記の効率を測定しました。その結果、転移因子の切り出しが起こる効率が高い菌が共通して持っている機能が未知な遺伝子を発見し、この遺伝子から産生されるタンパク質をIEE(insertion sequence-excision enhancer)と命名しました。
研究の内容・意義
- IEEを産生する遺伝子(iee遺伝子)は、ほとんどのO157(調査した510株のうちの約98%)が持っていますが、非病原性の大腸菌(K-12など)は持っていません。転移因子の切り出しが起こる効率は、O157からiee遺伝子を除去するとK-12と同等以下にまで低下し、逆に、K-12にiee遺伝子を持たせるとO157と同等以上にまで上昇しました(図4)。このことから、IEEがO157において、ゲノムから転移因子を切り出すための主要因子であることが明らかになりました。このような機能を持つタンパク質はもちろん、細菌が転移因子を切り出す仕組みを持っていること自体が世界で初めての発見です。
- O157の菌体内でIEEと転移酵素を強制発現させると、転移因子の分布を解析したパターン(すなわち菌株を特定する指紋)が一度の培養で様々に変化しました(図5)。この変化はIEEまたは転移酵素単独の発現では、ほとんど起こらないことから、このような転移因子の切り出しによる多様性獲得には、IEEと転移酵素の両方が必要であることがわかりました。
- 図6のように、転移酵素単独ではコピー&ペースト型転移だけが起こりますが、IEEが共存すると、コピー&ペースト型転移とカット&ペースト型転移の両方が起こります。またそれに加えて、IEEは転移酵素と協力して大規模なゲノム領域の欠失も起こすことが分かりました。観察された欠失は様々で、数パターンに分類されましたが、そのすべてがこれまでに自然界で分離されたO157のゲノム欠失のパターンと一致しており、自然界で起こっているO157の多様化が実験環境で再現されたと言えます。このような、IEEにより引き起こされるゲノム領域の欠失によるゲノムの多様化は、細菌の進化に関する新しいメカニズムを示すものと考えられます。
- ゲノム解析が完了した細菌について検索したところ、腸管出血性大腸菌の他にも様々な種類の細菌がIEEを産生する遺伝子を持っていることが明らかになりました。その中には、肺炎球菌、ブタ連鎖球菌、レジオネラ菌など人や動物に病気を起こすことで知られる細菌も含まれています。また、それぞれの菌におけるIEE周辺配列の詳細な解析により、IEEもまた転移因子などを介して様々な細菌種へと広がったことが推測されました。
今後の予定・期待
今回得られた知見は、細菌の進化または多様性の獲得に関する普遍的かつ新しいメカニズムを示すと考えられます。
動物、食品、環境などから人へと感染して病気を引き起こす病原性細菌の流行を防止するためには、その感染源や伝播経路を速やかに特定し、遮断することが重要です。前述のように、ゲノム上の様々な場所に存在する転移因子は細菌の株を示す指紋のように見なすことができます。今回、O157以外にもIEE産生遺伝子を持つ細菌種が見つかり、それらの細菌で、転移因子の分布解析による細菌のタイピングが進むと期待されます。
また、今後、転移因子が抜け落ちた後のゲノムをIEEがどのように修復し、転移因子を切り出しているかを解明することで、IEEを利用したO157の生き残り戦略に迫ることができると考えられます。さらには、それを逆手に取り、IEEを標的としてO157の増殖を抑制する方法の開発へとつながることが期待されます。
発表論文
Kusumoto, M., Ooka, T., Nishiya, Y., Ogura, Y., Saito, T., Sekine, Y., Iwata, T., Akiba, M. and Hayashi, T.
Insertion sequence-excision enhancer removes transposable elements from bacterial genomes and induces various genomic deletions.
Nature Communications 2:152 doi: 10.1038/ncomms1152 (2011)
用語の解説
- 腸管出血性大腸菌O157
- 人に対して出血性下痢や重篤な合併症などを引き起こす病原性細菌の一種。1996年に、大阪府堺市をはじめとして全国で1万人以上の感染者が出て大きな社会問題となりました。現在でも年間3~4千人の感染者が報告されており、死者も出ています。O157は人と動物に共通に感染し、人には出血性下痢から生死に関わる重篤な合併症まで様々な症状を引き起こします。一般に牛では無症状です。そのため、健康な牛がO157の保菌動物として最重要視されており、O157保菌牛の摘発、感染ルートの解明、牛の糞便への排菌を抑制するための研究などが急務です。
- 転移因子(トランスポゾンまたは動く遺伝子)
- ゲノム上のある場所から別の場所へ転移(移動)することが可能な塩基配列。転移因子は転移酵素の働きによって転移しますが、転移因子の配列には、この転移酵素をコードする配列も含まれています。転移因子には、転移酵素をコードする遺伝子と、転移酵素が結合するDNA配列だけのシンプルな構造のものから、薬剤耐性遺伝子など細菌に新たな性質を獲得させるような遺伝子を含んだものまで様々なものがあります。
- 転移酵素
- 転移因子(トランスポゾンまたは動く遺伝子)を動かす酵素。転移因子の末端にあるDNA配列に結合し、別の場所へ挿入します。転移酵素は、転移因子が抜け落ちた後のDNAを修復する機能を持っておらず、これまでゲノムからの転移因子が抜け落ちることはほとんどないと考えられてきました。
- タイピング
- 遺伝子構造を比較することによって細菌やウイルス等を分類、または個体(株)として識別する手法。細菌やウイルスをタイピングし、比較することによって、感染ルートを推定することができます。これまでは酵素によりDNAを切断したパターンを比較する方法や外来性遺伝子を比較する方法が主流でしたが、近年、転移因子の分布を比較する方法が迅速性や簡便性などの面から注目されています。
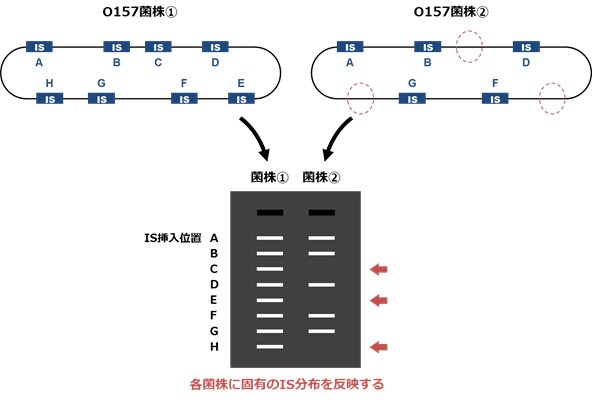
図1 転移因子IS629によるO157のタイピング
IS (Insertion Sequence)-printing法と呼ばれる手法で解析すると、ゲノム上の様々な挿入位置における転移因子IS629がバーコード状に表現されます。例えば、A~Hの位置にIS629が存在するO157菌株1とA・B・D・G・Fの位置にIS629が存在する(C・E・Hには存在しない)O157菌株2について解析すると、図のようなパターンが得られます。このパターンは菌株によって異なりますので、仮にO157感染患者と何らかの食品から分離された菌が同じパターンを示した場合は、この食品が感染源と疑われます。
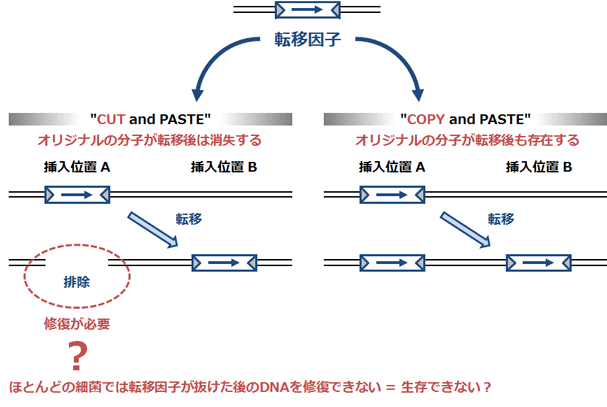
図2 転移のメカニズム
転移の仕方は、1転移元にオリジナルの分子が残らない「カット&ペースト型」と2オリジナルの複製分子が転移する「コピー&ペースト型」の2種類に大別されています。これまで、転移因子が抜け落ちた後のDNAは修復されず、ほとんどの細菌では、「カット」すなわちゲノムからの転移因子の切り出しは起こらない(起こっても菌が生存できない)と考えられてきました。
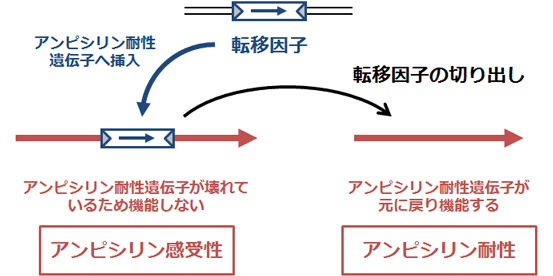
図3 転移因子の切り出しが起こる効率を測定する方法
転移因子の有無によって、菌の薬剤耐性が変化することを利用して、転移因子の切り出しが起こる効率を測定する方法を新たに開発しました。アンピシリン耐性遺伝子(細菌を抗生物質であるアンピシリンに対して抵抗性にする遺伝子)の中に転移因子が挿入されることによりアンピシリン耐性遺伝子が壊れた状態(左)の菌から転移因子が切り出されると、アンピシリン耐性遺伝子が復活して(右)菌がアンピシリンに対して耐性を示すようになります。アンピシリン感受性菌(アンピシリン存在下で生育できない菌)に対するアンピシリン耐性菌(アンピシリン存在下でも生育できる菌)の比率を、転移因子の切り出しが起こる効率としました。
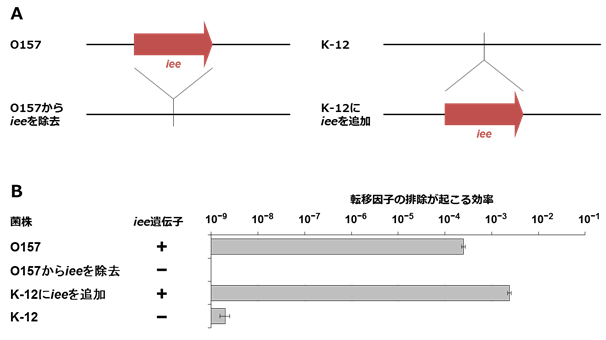
図4 転移因子の切り出しが起こる効率はiee遺伝子の有無に依存する
(A) O157のゲノムからiee遺伝子を除去した菌株と非病原性大腸菌K-12のゲノムにiee遺伝子を持たせた菌株を作製しました。
(B) 菌の由来(O157またはK-12)とは無関係にiee遺伝子を持つ菌株で転移因子の切り出しが起こる効率が高い(約100万倍)ことが分かります。
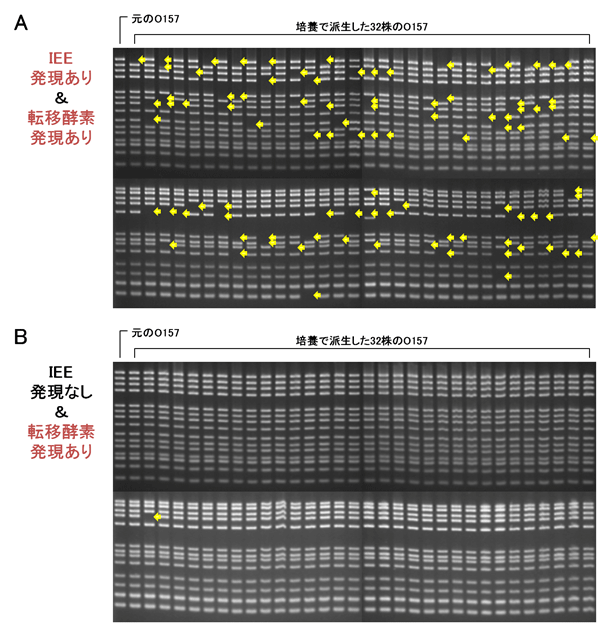
図5 IEEと転移酵素により引き起こされるO157ゲノムの多様化
IEEと転移酵素を強制発現させたO157(A)と転移酵素だけを発現させたO157(B)について、一般的に行われる方法で一晩培養し、生じた細菌株から、それぞれ32株をランダムに選びました。(A)、(B)のそれぞれについて、派生した細菌株と元のO157の合計33菌株についてタイピングを行ったところ(図1参照)、IEEと転移酵素の両方を発現させることによって派生したO157は様々なパターンを示しました。元のO157に対して、派生したO157でバーコードが欠けたように見える部分(矢印)は、その位置の転移因子(IS629)が切り出されていることを表します。この結果より、IEEと転移酵素の働きによってO157のIS629の分布パターンが多様化したことが分かります。
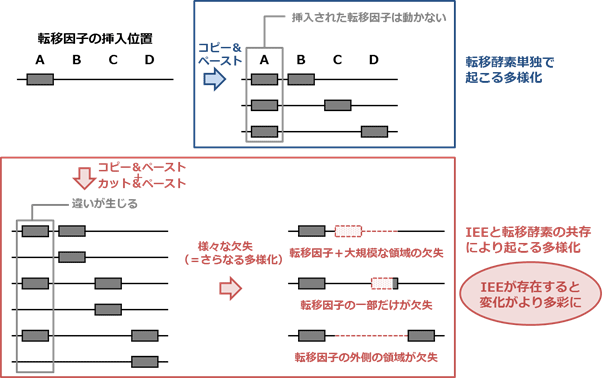
図6 IEEの存在によりゲノムがより高い多様性を獲得する
転移酵素単独ではコピー&ペースト型転移だけが起こるため、「コピー」の元となる転移因子はその場から動きません。しかしIEEが共存すると「カット」すなわちコピー元の転移因子が切り出された個体も生じるため、ゲノムの多様性が高まります。さらにIEEは様々なパターンでゲノム領域を欠失させるため、IEEが存在するとコピー&ペースト型転移、カット&ペースト型転移、その他の様々な欠失など多彩な変化が起こり、O157のゲノムがより高い多様性を獲得して進化すると考えられます。






