研究の背景
兎出血病は、ウサギの急性ウイルス感染症です。罹患したウサギは元気消失や食欲廃絶、発熱、時に神経症状や鼻出血などの症状を示し数日のうちに死亡しますが、何も症状を示さないまま突然死することもあり、致死率は90%に達するとの報告もあります。本病は1994年に我が国で初めて疑い事例が確認され1998年に届出伝染病に指定された後、2000年に東京都、2002年に北海道でそれぞれ1例ずつ発生報告がありました。その後、17年間発生はありませんでしたが、2019年5月の愛媛県での発生以降、2020年7月までの約1年間に6県において計9例発生する流行が国内で初めて確認されました。また、2021年以降も散発的に発生が確認されています。
本病の原因ウイルスは、カリシウイルス科に分類される兎出血病ウイルスで、RHDV-GI.1及びRHDV2-GI.2という遺伝子型に大別され、RHDV-GI.1はRHDVa-GI.1a、RHDV-GI.1b、RHDV-GI.1c及びRHDV-GI.1dの4種類の遺伝子型に分類されます。RHDV-GI.1b~RHDV-GI.1dは1984年からの国際的流行で確認され、RHDVa-GI.1aは1997年から確認されています。これらは主に8週齢以上の家兎を中心として被害をもたらしました。一方、RHDV2-GI.2は2010年にフランスで出現した新しい変異ウイルスであり、家兎の若齢個体や野兎でも発生が確認されるのが特徴です。現在、RHDV2-GI.2は世界的にまん延しており、家兎の被害だけではなく、野兎の個体数減少による生態系への影響も懸念されています。このような兎出血病ウイルスの病原性変化をもたらした一因として、重複感染時の遺伝子組換え3) によるウイルス進化が挙げられます。RHDV2-GI.2では、RHDV-GI.1bやウサギに病原性を示さないウサギカリシウイルス(RCV-E1-GI.3など)との遺伝子組換えが確認されています。
今回、兎出血病の発生要因を理解し今後の対策に資するために、2000年東京都、2002年北海道、2019年愛媛県、2019年茨城県、2020年栃木県及び2020年千葉県の発生例より採取した検体を用いて原因ウイルスの全ゲノム配列決定と遺伝子解析を行いました。
研究の内容・意義
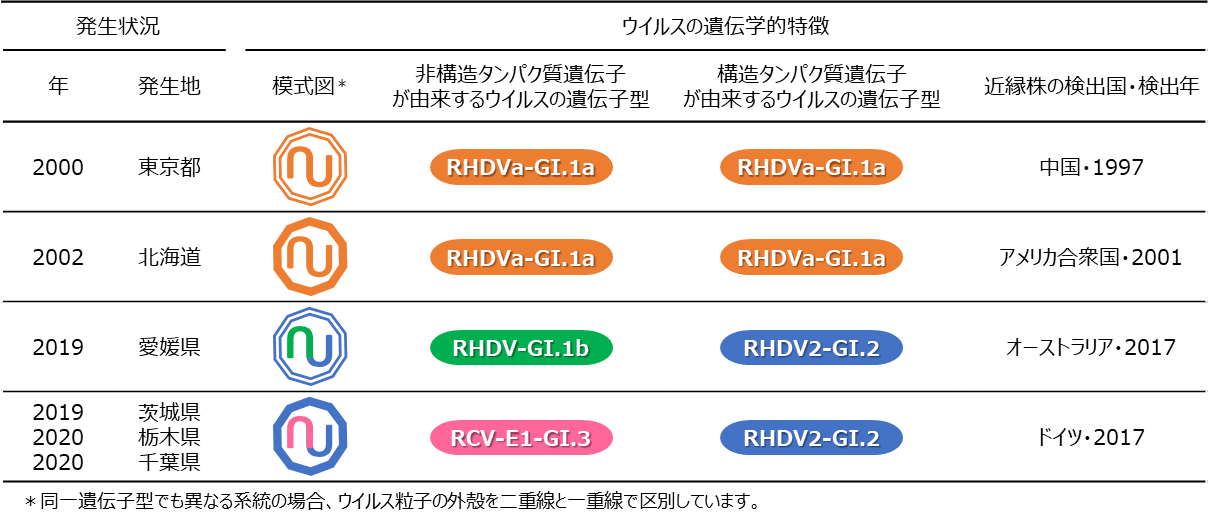
2000年東京都及び2002年北海道の発生例 : 検出された株は、共にRHDVa-GI.1aに分類される非遺伝子組換え株でしたが、塩基配列一致率は97.2%と互いの類似性は低く、それぞれ1997年に中国で検出された株と2001年にアメリカ合衆国で検出された株に最も近縁でした(表1 )。
2019年愛媛県の発生例 : 検出された株は、ウイルスの非構造タンパク質遺伝子と構造タンパク質遺伝子4) がそれぞれRHDV-GI.1bとRHDV2-GI.2の組み合わせであり、2017年にオーストラリアで検出された遺伝子組換え株に最も近縁でした(表1 )。
2019年茨城県、2020年栃木県及び2020年千葉県の発生例 : 検出された株は、互いに99.4-99.7%の塩基配列一致率を示しました。これらの株は、ウイルスの非構造タンパク質遺伝子と構造タンパク質遺伝子がそれぞれRCV-E1-GI.3とRHDV2-GI.2の組み合わせであり、2017年にドイツで検出された遺伝子組換え株に最も近縁でした(表1 )。
以上のことから、2000-2020年の国内における兎出血病の発生は、海外からのウイルス株の複数回の侵入に起因する可能性が示唆されました。
表12000~2020年までの兎出血病6発生例より検出されたウイルスの遺伝学的特徴
今後の予定・期待
兎出血病ウイルスは環境中での生存性が高いことが明らかになっています。ウサギを飼養する施設では日頃から衛生管理を徹底し、人や物、海外や他農場からの導入ウサギ等を介したウイルス侵入を防止する必要があります。農研機構では今後も情報収集につとめ、検査診断法の開発による監視体制の強化と予防法開発を積極的に行っていきます。
用語の解説
ウサギ
一般に愛玩用、実験用、肉用、毛用を目的として国内で飼育されているウサギはウサギ科アナウサギ属に分類されるアナウサギ(Oryctolagus cuniculus )を原種とします。一方、国内外において野生に生息するウサギは主にウサギ科ノウサギ属(Lepus spp. )に分類されます。本文では、アナウサギを原種とする飼育されているウサギを家兎、野生に生息するウサギを野兎、家兎と野兎の両方を含む場合にはウサギと記載しています。[概要へ戻る]
兎出血病ウイルスと遺伝子型
カリシウイルス科ラゴウイルス属に分類されるウサギに感染するカリシウイルスのうち、兎出血病を起こすウイルスは兎出血病ウイルス(rabbit hemorrhagic disease virus, RHDV)、病気を起こさないものはウサギカリシウイルス(rabbit calicivirus, RCV)と命名されています。兎出血病ウイルスとウサギカリシウイルスは、ウイルスの外殻を構成するタンパク質の塩基配列に基づき、RHDVa-GI.1a、RHDV-GI.1b、RHDV-GI.1c及びRHDV-GI.1dからなるRHDV-GI.1及びRHDV2-GI.2、並びにRCV-E1-GI.3及びRCV-A1/E2-GI.4に分類されています。[概要へ戻る]
遺伝子組換え
遺伝子組換えとは、異なるウイルス株が一つの細胞に重複して感染した場合に、互いのウイルス遺伝子の一部が組み換わることです。兎出血病ウイルスでは非構造タンパク質遺伝子と構造タンパク質遺伝子との間を境として遺伝子組換えを起こした株が多く確認されています。[研究の背景へ戻る]
構造タンパク質と非構造タンパク質
ウイルスの粒子を構成するタンパク質を構造タンパク質、それ以外のウイルスの複製や増殖に関わるタンパク質などを非構造タンパク質といいます。兎出血病ウイルスは一本につながったウイルスゲノムの上流に非構造タンパク質遺伝子、下流に構造タンパク質遺伝子が配置されています。[研究の内容・意義へ戻る]
発表論文
Tanikawa T, Watanabe S, Mikami O, Miyazaki A. Genetics of the rabbit haemorrhagic disease virus strains responsible for rabbit haemorrhagic disease outbreaks in Japan between 2000 and 2020. J Gen Virol. 2023 May;104(5). doi: 10.1099/jgv.0.001846.