開発の背景
消化管の機能が精神的ストレスにより異常をきたすことは、よく知られています。これは、心理的な苦痛により引き起こされるストレスが、交感神経系や内分泌系を介して脳から腸に伝達され、腹痛・下痢・膨満感などの不快な反応を引き起こすためです。逆に、腸管の受けた不快な感覚は脳に伝達され、さらにストレス症状を悪化させます。また、精神的ストレスは消化管の機能に悪影響をもたらすと共に、腸内細菌叢も変動させますが、そのメカニズムについてはよくわかっていません。このような脳と腸・腸内細菌の機能的な関係は、「腸内細菌-腸-脳相関」と呼ばれます(図1)。
研究の経緯
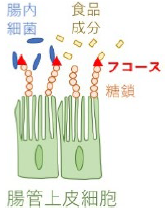
小腸の内壁を覆う腸管上皮細胞は表面に糖鎖を発現しています。この糖鎖は、腸内細菌や食品成分が腸管上皮細胞に付着する部位を提供しています(図2)。糖鎖の分子構造は複雑であり、従来からの質量分析法などでは構造の解析が困難でした。今回の研究は、レクチンマイクロアレイ技術を用いて、精神的ストレスが腸管上皮細胞の糖鎖に与える影響を網羅的に解析しました。
研究の内容・意義
レクチンマイクロアレイにより、マウスにおいて、腸管上皮細胞のフコース結合糖鎖(フコシル化糖鎖)が、精神的ストレス(社会的敗北ストレス)負荷により減少することを明らかにしました(図3)。
精神的ストレス負荷によるフコシル化糖鎖の減少が観察されたのは、小腸下部の腸管上皮のみで、小腸上部や大腸の腸管上皮では、フコシル化糖鎖の減少が認められませんでした。このことは、腸管上皮細胞の糖鎖にフコースを付加する「フコース転移酵素」の遺伝子発現が、精神的ストレス負荷により小腸下部で特異的に低下した結果からも裏付けられました(図4)。
今後の予定・期待
精神的ストレスが様々な腸管機能や腸内細菌叢に変動をもたらす詳細なメカニズムについては、明らかになっていません。糖鎖の末端に付加されるフコースは腸管上皮細胞における腸内細菌の付着部位であると共に、腸内細菌の栄養源としても利用されることが報告されており、フコシル化糖鎖の減少は腸内細菌叢の変動をもたらすと考えられます。本研究成果は、精神的ストレスの負荷によって腸内細菌叢が変動する「腸内細菌-腸-脳相関」のメカニズムの解明につながると期待されます。
用語の解説
- 腸管上皮細胞:腸の内壁を構成する細胞。バリアとして機能すると共に、栄養素を吸収し、腸内細菌や食品成分に応答する性質があります。
- 糖鎖:複数の単糖(グルコース・マンノース・フコースなど)がグリコシド結合により重合した化合物。腸管において、糖鎖は様々な腸内細菌の付着部位として機能する他に、腸内細菌の栄養源としても利用されます。
- フコシル化糖鎖:単糖の一種であるフコースが末端に付加された糖鎖。腸管上皮細胞において、この反応を触媒する酵素がフコース転移酵素です。
- 腸内細菌-腸-脳相関:脳が受けた精神的ストレスが腸管機能の不調をもたらし、逆に腸の不快な感覚が脳に伝達されることでストレス症状が悪化することが知られています。さらに、精神的ストレスは腸内細菌叢を変動させますが、特定の腸内細菌は、直接的または間接的に脳機能に影響を与えることが知られています。このような、脳と腸・腸内細菌の機能的な関連を「腸内細菌-腸-脳相関」と呼びます。
- レクチン、レクチンマイクロアレイ(技術):特定の種類の糖鎖構造に対して結合する性質を持つタンパク質。レクチンとの結合性を検討することで、おおまかな糖鎖の構造を推定することが可能になります。さらに多数のレクチンを用い、特定の組織や細胞に発現している糖鎖を網羅的に検出するための技術が、レクチンマイクロアレイです。
- 社会的敗北ストレス:雄マウス(またはラット)の縄張り本能を利用し、自分より優位の個体と同じ飼育ケージで一定時間共存させることで、社会性行動の減少を引き起こす精神的ストレスのモデル。
発表論文
Omata, Y., Aoki, R., Aoki-Yoshida, A., Hiemori, K., Toyoda, A., Tateno, H., Suzuki, C., & Takayama, Y. (2018) Reduced fucosylation in the distal intestinal epithelium of mice subjected to chronic social defeat stress. Scientific Reports 8, 13199 DOI: 10.1038/s41598-018-31403-8
参考図
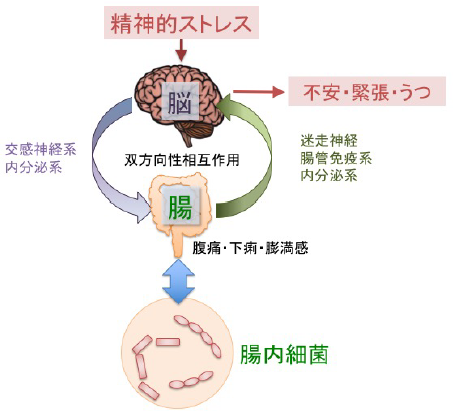
図1 腸内細菌-腸-脳相関
脳に加えられた精神的ストレスは、中枢神経系や内分泌系を介して腸に伝達され、腹痛・下痢のような消化器症状や膨満感のような不快な感覚を引き起こします。また、腸の感覚刺激は逆に脳に伝えられ、精神的ストレスの症状を悪化させます。さらに、精神的ストレスは腸内細菌叢を変動させますが、特定の腸内細菌は直接的または間接的に、脳機能に影響を与えます。このような脳と腸・腸内細菌の機能的な関連は、「腸内細菌-腸-脳相関」とよばれます。
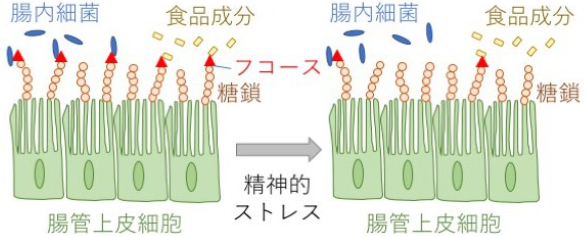
図2 精神的ストレス負荷によるフコース結合糖鎖(フコシル化糖鎖)の減少
腸管上皮細胞は表面に糖鎖を発現しています。この糖鎖は腸管上皮細胞が腸内細菌や食品成分と相互作用するために重要な役割を果たしています。一方、心理的な苦痛により引き起こされるストレスが、交感神経系や内分泌系を介して脳から腸に伝達されると末端にフコースが付加された糖鎖(フコシル化糖鎖)が減少し、腸管上皮細胞と腸内細菌や食品成分の相互作用に影響を与えると考えられます。
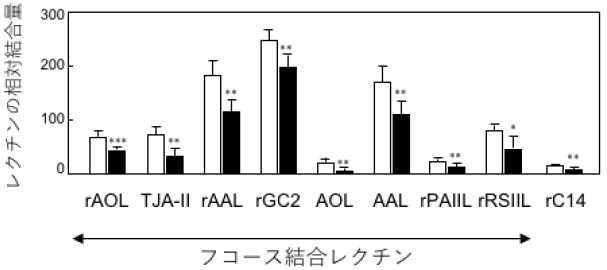
図3 精神的ストレス負荷により腸管上皮の糖鎖に対するレクチン反応性が減少する
レクチンマイクロアレイにより96種類のレクチンについて、精神的ストレス負荷なし(□)・あり(■)の時の反応性を比較しました。その結果、上記の9種類のレクチンが精神的ストレス負荷により反応性が有意に低下することがわかりました。9種類のレクチンのうち、rC14を除く8種類がフコース結合性レクチン(α1,2-フコース結合性レクチン)でした。この低下は、小腸上部や大腸では観察されませんでした。エラーバーは標準偏差で、***は0.1%、**は1%,*は5%の有意水準で有意差を示します。
この結果は、腸管上皮細胞のフコシル化糖鎖が、精神的ストレス負荷により減少することを示しています。
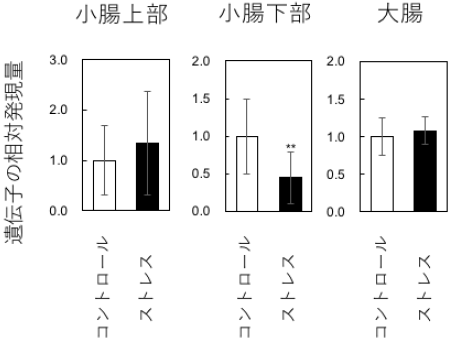
図4 精神的ストレス負荷がフコース転移酵素2遺伝子の発現に与える効果
□は精神的ストレスなし、■は精神的ストレス負荷ありのマウスの腸管上皮のフコース転移酵素2遺伝子の発現量(コントロールを1.0とした相対量)です。精神的ストレス負荷により、小腸下部でのみフコース転移酵素遺伝子2の発現量の減少が認められます。エラーバーは標準偏差で、**は1%の有意水準で有意差を示します。
 精神的ストレスは消化管の機能に悪影響をもたらすと共に、腸内細菌叢(そう)を変動させることがよく知られています。逆に、腹痛などの腸管の不快な感覚や、特定の腸内細菌の産生する代謝産物の刺激は脳に伝達され、ストレスの症状をさらに悪化させます(腸内細菌−腸−脳相関4))。
精神的ストレスは消化管の機能に悪影響をもたらすと共に、腸内細菌叢(そう)を変動させることがよく知られています。逆に、腹痛などの腸管の不快な感覚や、特定の腸内細菌の産生する代謝産物の刺激は脳に伝達され、ストレスの症状をさらに悪化させます(腸内細菌−腸−脳相関4))。



