ゲノム編集技術CRISPR/Cas9法により標的遺伝子に変異導入したリンゴを効率的に作成できる
要約
リンゴ品種「JM2」にCas9とgRNA を形質転換することによって、ゲノム編集個体が得られる。ゲノム編集個体が得られる割合はgRNA配列により異なり、gRNA配列を最適化することにより標的配列への変異導入効率の向上が期待できる。
- キーワード:ゲノム編集、リンゴ、CRISPR/Cas9
- 担当:果樹茶業研究部門・品種育成研究領域・ゲノムユニット
- 代表連絡先:電話 029-838-6453
- 分類:研究成果情報
背景・ねらい
ゲノム編集とは、ゲノムDNAの任意の部位に変異を入れて遺伝子機能を改変することができる技術である。ゲノム編集技術の一種CRISPR/Cas9法は、最も単純にはCas9 ヌクレアーゼと標的配列に相同な配列を含むgRNA(ガイドRNA)の複合体により標的のDNAを切断し、その部位でのDNA修復エラーによって変異を誘発する手法である。これまでさまざまな植物種において、遺伝子機能の解明や育種への応用を目的としてCRISPR/Cas9法によるゲノム編集個体の獲得が報告されてきたが、世界的にも重要なリンゴなどの果樹での成功例は報告されていない。そこで、リンゴゲノム編集技術の開発を行う。
成果の内容・特徴
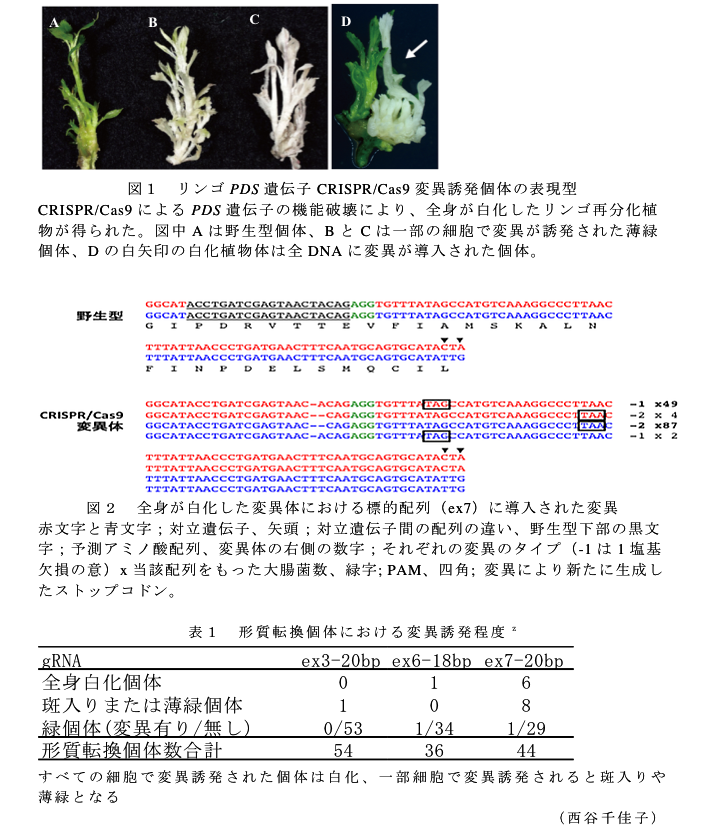
- 機能破壊により細胞が白化するモデル遺伝子のPDS(Phytoene Desaturase)遺伝子について、本来のターゲットと類似した異なる配列にも変異が誘発される可能性が低いと予測される3箇所の配列(ex3、ex6、ex7)がCRISPR/Cas9の標的配列として適切である(データ省略)。
- リンゴ台木品種「JM2」に、それぞれの標的配列についてCas9とgRNAを形質転換し、形質転換個体を作出した結果、白化個体が得られ(図1)、シーケンス解析により標的配列で変異が確認されたことから(図2)、本方法によるリンゴゲノム編集が可能である。シーケンス解析は、野生型個体および全身白化個体について、標的配列の周辺をPCRで増幅し、その産物を大腸菌にクローニングしてランダムにピックアップして配列を確認した結果である。全身が白化したCRISPR/Cas9変異体の多くは、1つの対立遺伝子あたり変異配列が2種類検出され、主要な変異タイプと副次的な変異タイプに分かれる。副次的な変異タイプは互いにもう一方の対立遺伝子の主要な変異タイプと同一の変異配列である。
- 完全な白化個体が得られる割合はgRNA配列により異なり(0~14%、表1)、gRNA配列を最適化することにより標的配列への変異導入効率の向上が期待できる。
成果の活用面・留意点
- 本研究において有効性を確認したCRISPR/Cas9法によるゲノム編集技術は、リンゴにおいて様々な遺伝子の機能改変に役立つ。
- 本研究では外来遺伝子を導入した遺伝子組換え個体を作成してゲノム編集を誘発したが、ゲノム編集は一度編集が誘発されると外来遺伝子が不要となることから、リンゴでのゲノム編集技術の実用化に向けて外来遺伝子を除去する、または外来遺伝子を使用しないゲノム編集技術の開発が必要である。
- 一般的にgRNAに用いる20bpより短い18bpのgRNA(tru-gRNA)を用いた場合もゲノム編集が誘発され(表1)、シロイヌナズナではtru-RNA を用いてオフターゲット効果を抑制できるという知見があることから、リンゴでも同様にオフターゲット効果を抑えられる可能性がある。
具体的データ
その他
- 予算区分:交付金、その他外部資金(SIP)
- 研究期間:2014~2016年度
- 研究担当者:西谷千佳子、平井徳美、小森貞男(岩手大農)、和田雅人、岡田和馬、刑部敬史(徳島大生物資源産業)、山本俊哉、刑部祐里子(徳島大生物資源産業)
- 発表論文等:Nishitani C. et al. (2016) Sci. Rep. 6 Article number: 31481
