タンパク質分解酵素であるカルパイン3の活性を検出するプローブ
要約
タンパク質分解酵素であるカルパイン3の酵素活性を検出するプローブにより、活性化したカルパイン3を可視化する手法である。生きた骨格筋細胞内でカルパイン3の活性化状態をモニターできるため、時空間的なカルパイン3の酵素学的な性質を明らかにすることができる。
- キーワード:骨格筋、カルパイン、タンパク質分解酵素、食肉
- 担当:畜産研究部門・畜産物研究領域・食肉制御ユニット
- 代表連絡先:
- 分類:研究成果情報
背景・ねらい
カルパインは基質となるタンパク質を切断するタンパク質分解酵素である。家畜等の動物生体内において10種類以上のカルパインが存在し、受精、細胞分化など多様な生命活動に関与する。カルパインはカルシウムイオンにより活性化されるタンパク質分解酵素であり、タンパク質をアミノ酸レベルにまでバラバラに分解する細胞内の大規模なタンパク質分解システム(オートファジーやユビキチンプロテアソームシステムなど)とは異なり、特異的な基質のみを限定的に切断する。骨格筋が食肉に変換する食肉軟化(熟成)過程において、カルパインが骨格筋細胞内の主要な構造タンパク質を切断することで、骨格筋を食肉としての適度な堅さに変化させ、ペプチドを増加し風味を向上させることがカルパインの作用としてよく知られている。食肉のもととなる骨格筋細胞にはカルパイン3が特異的に発現しており、カルパイン3の酵素活性を喪失すると骨格筋萎縮を引き起こす。そのため、骨格筋が正常に成長・肥大するためには、カルパイン3の酵素活性は必要不可欠である。これまで、酵素学的に活性化したカルパイン3を検出するためには、骨格筋細胞・組織をすりつぶした試料を用い、抗体により検出する方法が一般的である。そのため、単一の細胞レベルでリアルタイムに活性化したカルパイン3をモニターすることが出来ず、いつ、どのような刺激によりカルパイン3が活性化するのかという時空間的な酵素活性制御機構は不明である。
そこで、酵素学的に活性化したカルパイン3を細胞内で検出するためのプローブを開発し、生きた細胞内で活性化したカルパイン3を可視化する。
成果の内容・特徴
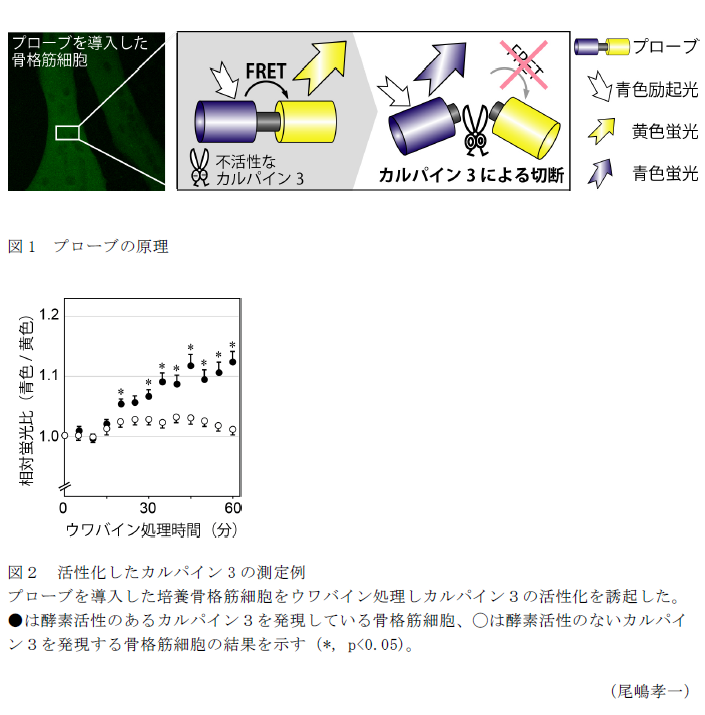
- 本プローブにはカルパイン3が切断する特異的なアミノ酸配列が青色蛍光タンパク質と黄色蛍光タンパク質の間に挿入されている。プローブが切断されない状態では、Förster共鳴エネルギー移動(FRET)1)により、青色蛍光タンパク質の励起波長により黄色蛍光が観察される(図1)。
- カルパイン3によりプローブが切断されると、FRETも解消されるため、青色の蛍光が観察される。そのため、酵素学的に活性化したカルパイン3をプローブの蛍光波長変化の割合(青色蛍光/黄色蛍光)が上昇として検出することが可能になる(図2)。
1)Förster共鳴エネルギー移動(FRET)
異なる蛍光波長をもつ蛍光分子AとBが存在した場合、本来であればAの励起光により蛍光Aを、Bの励起光により蛍光Bを発する。AとBが十分に近接して存在した場合、Aの励起光によりBが励起され蛍光Bを発する。この現象をFörster共鳴エネルギー移動という。
成果の活用面・留意点
- 培養骨格筋細胞にどのような刺激を与えるとカルパイン3の活性化が細胞内のどこで起きるのかを検出する際に活用できる。
- プローブはプラスミドであるため、細胞に導入して発現させる必要がある。
- プローブを検出するための蛍光顕微鏡が必要となる。
具体的データ
その他
- 予算区分:競争的資金(科学研究費補助金、内藤記念科学研究助成)
- 研究期間:2014~2020年度
- 研究担当者:尾嶋孝一、秦勝志(都医学研)、大内史子(都医学研)、大江美香、室谷進、反町洋之(都医学研)、小野弥子(都医学研)
- 発表論文等:Ojima K. et al.(2020)Biol. Open. 9:bio048975
