ヒマワリ種子アスパラギン酸プロテアーゼの性質とプロセッシング機構
※アーカイブの成果情報は、発表されてから年数が経っており、情報が古くなっております。
同一分野の研究については、なるべく新しい情報を検索ください。
要約
ヒマワリ種子のアスパラギン酸プロテアーゼは朝鮮アザミや大麦の酵素よりインスリンB鎖に対して厳密な基質特異性を示した。また、本酵素は自己触媒的に47kDaの成熟型酵素から29と9kDaのサブユニットからなる酵素にプロセッシングされた。
- 担当:食品総合研究所・生物機能開発部・分子情報解析研究室
- 代表連絡先:0298-38-8063
- 部会名:食品
- 専門:バイテク
- 対象:ヒマワリ
- 分類:研究
背景
植物のアスパラギン酸プロテアーゼとしては、大麦、米、朝鮮アザミの酵素が精製され、性質が検討され、その一次構造が明らかになっている。植物由来のアスパラギン酸プロテアーゼには約100アミノ酸残基からなる植物酵素特異的領域が存在し、その部分がプロセッシングを受けることが知られている。本酵素のプロセッシング機構及び基質特異性については十分明らかになっているとは言えない。そこで、ヒマワリ種子中の酵素を精製し、その基質特異性、一次構造、及びプロセッシングの機構について検討を加えた。
成果の内容・特徴
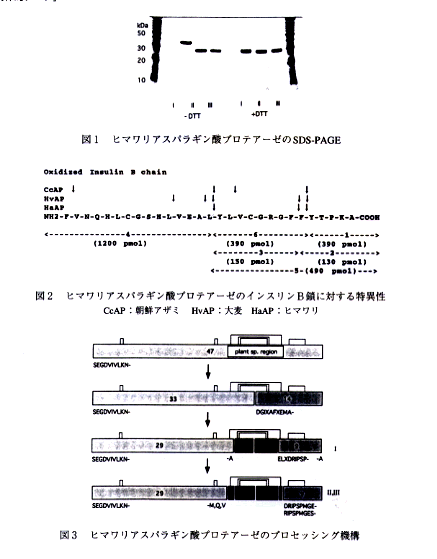
- ヒマワリ種子より抽出した粗酵素を、アスパラギン酸プロテアーゼの特異的な阻害剤であるペプスタチンをリガンドとするアフィニティークロマト及びイオン交換クロマトで精製した。収率約50%で精製酵素 (I, II, III) が得られた。SDS-PAGEの結果を図1に示した。
- 精製酵素の至適pHは2.5、安定pHは4-7、至適温度は40°C、35°Cまで安定であった。図2に朝鮮アザミ、大麦、ヒマワリのアスパラギン酸プロテアーゼのインスリンB鎖に対する基質特異性を示した。これらの酵素は疎水性アミノ酸の間のペプチド結合に対して作用し、ヒマワリの酵素は大麦の酵素に比べて更に特異性が厳密であった。
- ヒマワリ種子から全RNAを抽出し、mRNA画分を精製し、本酵素のN-末端アミノ酸配列と内部配列を元に合成したオリゴヌクレオチドプライマーを用いてRT-PCRを行い、約800bpのDNA断片を得た。更に5'-RACE、3'-RACEを行い、全長のcDNAを得た。その結果、成熟型酵素は440個のアミノ酸からなり、分子の大きさは47kDaであった。他の起源のアスパラギン酸プロテアーゼのアミノ酸配列に対する相同性は30-78%であった。
- 精製酵素のN-末端アミノ酸分析の結果から、図3に示すようにヒマワリの酵素は100アミノ酸残基からなる植物特異的領域に対して自己触媒的に作用し、47kDaの成熟型酵素から、29kDaと9kDaのサブユニットからなる酵素 (I, II, III) にプロセッシングされることを明らかにした。
成果の活用面・留意点
種子中に存在すると考えられるこの酵素の内在性基質を探索することにより、その生理的役割の解明が期待できる。
具体的データ
その他
- 研究課題名:植物種子の蛋白質分解の動的研究
- 予算区分:経常
- 研究期間:平成11年度(平成7~11年)
- 研究担当者:小林秀行
- 発表論文等:H.Kobayasi et al.:Purification and characterization of aspartic proteinase from sunflower seeds.Biosci.Biotecnhnol.Biochem.,64(5),931-939(2000)
