遺伝子組換えによる高活性サイクロデキストラン合成酵素の作出
※アーカイブの成果情報は、発表されてから年数が経っており、情報が古くなっております。
同一分野の研究については、なるべく新しい情報を検索ください。
要約
遺伝子組換えによって、従来の酵素より4倍活性が上昇したサイクロデキストラン合成酵素を作出した。比活性が上昇した変異サイクロデキストラン合成酵素は野生型よりも反応速度が上昇した以外には大きな変化がみられず、いずれも酵素反応にはカルボキシアミノ酸が重要と推定される。
- 担当:食品総合研究所・食品素材部・糖質素材研究室
- 代表連絡先:糖質素材研究室 0298-38-8132
- キーワード:サイクロデキストラン、サイクロデキストラン合成酵素、変異、カルボキシアミノ酸
- 分類:参考
背景
サイクロデキストラン合成酵素(CITase)は、デキストランから抗う蝕性環状オリゴ糖サイクロデキストラン(CI)を生産する酵素である。CIの大量生産を目指すため、CITaseを改良して比活性が上昇した2種類の変異酵素、V744LおよびA452Nを取得したが、これらがなぜ活性上昇したかを解明するため、変異酵素の諸性質を野生型酵素と比較した。さらに、CITaseの活性中心のアミノ酸残基を明らかにするために化学修飾を行った。以上合わせてCITase酵素分子に関する基礎的知見を得て今後の酵素改良技術開発につなげることを目的とした。
成果の内容・特徴
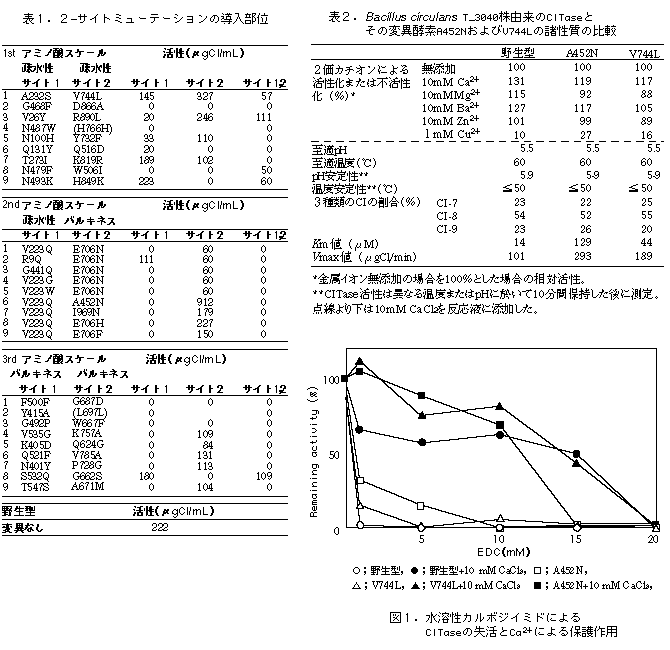
- CITaseの744番目のValをLeuに変えたV744Lおよび452番目のAlaをAsnに変えたA452Nが野生型酵素よりも活性が上昇した。他の変異酵素は活性が野生型と同等か、低下した。特に2箇所変異を導入したものに活性の著しい低下がみられた(表1)。
- 野生型酵素と変異型酵素V744LおよびA452Nでは、至適温度、至適pH、温度安定性、pH安定性、二価金属イオンの作用には大きな差が見られなかった。変異酵素のKm値が多少上昇したが、通常のCI生産反応ではこの基質親和性の低下は障害とならないレベルであった。反応速度がV744Lは野生型の2倍、A452Nは3倍に上昇し、これが変異型酵素の比活性の上昇をもたらしたものと考えられる(表2)。
- 水溶性カルボジイミドにより化学修飾を行った結果、変異型、野生型いずれの酵素もCa非存在下で著しく失活し、カルボキシアミノ酸が酵素活性発現に重要な役割を果たすと考えられ、これらの変異部位は活性中心部位とは離れた位置であると推定できた。また、いずれの酵素もCa存在下では失活が抑制されたことからCaによって酵素が安定化されると考えられる(図1)。
- 以上2種類の変異酵素は変異部位が互いに離れているにもかかわらず、類似した性質を持っていたことから、V744LおよびA452Nの変異が互いに似通った酵素の構造変化をもたらしたと考えられる。
成果の活用面・留意点
CITaseの活性中心には必須カルボキシアミノ酸が存在すると推定されたが、今後CITaseを実用化に向けてさらに改良するためには酵素の活性中心部位の特定を行うことが重要と考えられる。一方、V744LとA452Nといった活性中心以外に変異を導入した酵素に反応速度の上昇が見られたことから、活性中心以外の部位が酵素全体の構造に与える影響も解明する必要があり、酵素の分子構造解析が今後必要と考えられる。
具体的データ
その他
- 研究課題名:糖転移酵素の反応機構の解明
- 予算区分:経常
- 研究期間:1999~2001年度 (2001年度)
- 研究担当者:舟根和美
- 発表論文等:1) K. Funane et al. Reaction of a rice branching enzyme RBE1 on various kinds of starches analyzed by high performance anion exchange chromatography, J. Appl. Glycosci., 46(4)453-457(1999)
2) K. Mizuno et al. Characterization of an isoform of rice starch branching enzyme, RBE4, in developing seeds, Plant Cell Physiol., 42(4)349-357(2001)
3) 舟根和美, 抗う蝕性環状オリゴ糖サイクロデキストラン, 老化制御と食品, 第4章, 4.8.1-4.8.5. p378-388(2002)
