イネに由来するリボゾーム不活性化に関わる遺伝子
※アーカイブの成果情報は、発表されてから年数が経っており、情報が古くなっております。
同一分野の研究については、なるべく新しい情報を検索ください。
要約
コムギに由来するリボゾーム不活性化タンパク質RALyaseの相同遺伝子をイネから単離した。この遺伝子の翻訳産物はRALyase活性を持つタンパク質であった。
- 担当:食品総合研究所・生物機能開発部・微生物機能研究室
- 代表連絡先:微生物機能研究室 0298-38-8124
- キーワード:RALyase、RIP、リボゾーム
- 分類:参考
背景
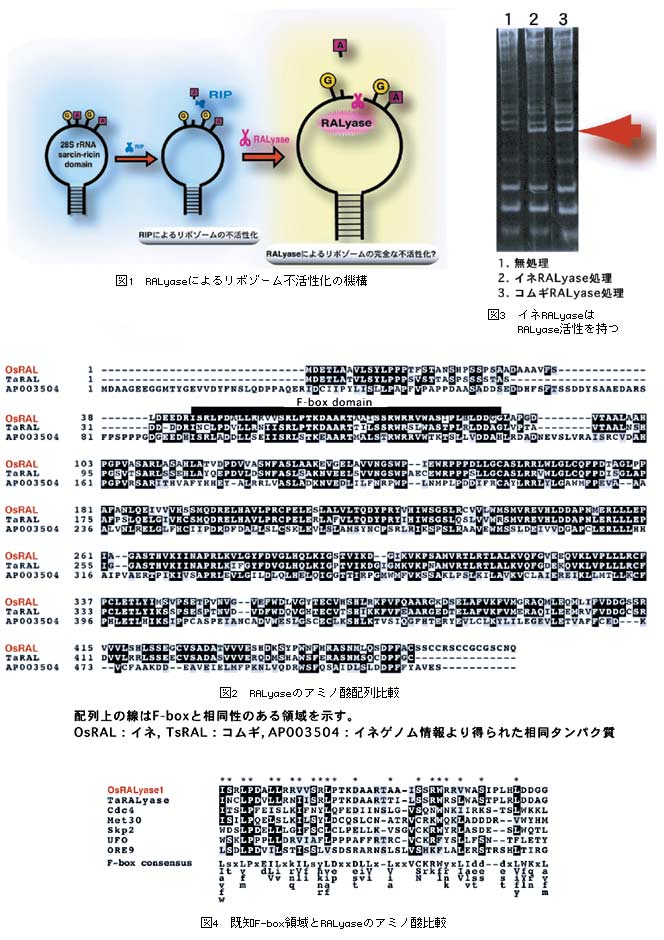
植物のリボゾームの不活性化機構のひとつとして植物自身が持つRibosome inactivating protein (RIP)の作用が知られている。RIPは植物の病害抵抗性機構に関与しているという報告がある。RIPはリボゾームRNA(rRNA)中の特定のループ構造中のアデニン塩基を切断しリボゾームを不活性化するが(図1)、最近、このRIPの作用点を認識してrRNAの骨格を切断するRNA apurinic site specific lyase (RALyase)(図1)がコムギより発見された。その酵素活性よりRIPと同様、リボゾーム不活性化因子であると考えられるが、その生物学的存在意義に関しては今のところ明らかでない。そこで我々はRALyaseの生物学的存在意義を明らかにするための解析を始めた。研究推進上、遺伝子情報が豊富で、遺伝子破壊株の利用、遺伝子組換え体の利用が行いやすいイネを材料とすることが有利と考えられるため、新たにイネよりRALyase遺伝子を単離、解析を行った。
成果の内容・特徴
- イネゲノムライブラリよりコムギRALyase遺伝子の相同性遺伝子を単離した。本遺伝子の予想アミノ酸配列はコムギRALyaseと高い相同性を示した(図2)。
- イネRALyase遺伝子を試験管内で合成したタンパク質は明確な活性を示し、単離した遺伝子がコムギRALyaseと同一の作用をもつことを明らかにした(図3)。
- アミノ酸配列の検討から、イネ及びコムギのRALyaseにはF-boxドメインと呼ばれる細胞分裂周期・分化に関わるタンパク質と結合する領域が見いだした。RALyaseの生体内機能を推定する上で重要な情報である(図4)。
成果の活用面・留意点
RALyaseは植物の病害抵抗性機構に関与するタンパク質である可能性があり、新たな病害抵抗性植物の育種に繋げることができる。
具体的データ
その他
- 研究課題名:「リボゾーム工学」の構築と生物の潜在能力開発
- 予算区分:開放融合
- 研究期間:1998~2002年度 (2001年度)
- 研究担当者:伊藤康博・小澤彰彦(愛媛大)・澤崎達也(愛媛大)・遠藤弥重太(愛媛大)・越智幸三・戸澤 譲(三菱化学生命研)
