いんげん豆の加工と蛋白質消化性との関係の解明
※アーカイブの成果情報は、発表されてから年数が経っており、情報が古くなっております。
同一分野の研究については、なるべく新しい情報を検索ください。
要約
いんげん豆粉に難消化性蛋白質を見出し、レグミン(11Sグロブリン)のβ-サブユニットであることを示した。加熱粗粉砕や酵素処理等の加工処理と、いんげん豆蛋白質の消化性の関係をin vitro ペプシン消化試験を用いて明らかにした。
- キーワード:ペプシン消化耐性、レグミン、ジズルフィド蛋白質
- 担当:食総研・食品素材科学研究領域・蛋白質素材ユニット
- 連絡先:電話029-838-8051
- 区分:食品試験研究
- 分類:研究・参考
背景・ねらい
いんげん豆は約20%の蛋白質を含み、デンプンや食物繊維が豊富で、優れた食糧資源の一つである。しかし、現在のところ我が国で は主として煮豆や菓子類に利用が限られており、食品蛋白質としての特性についても不明な点が多い。本課題では、いんげん豆蛋白質の試験管内消化性を調べ、 加工処理と蛋白質消化性の関係を明らかにした。
成果の内容・特徴
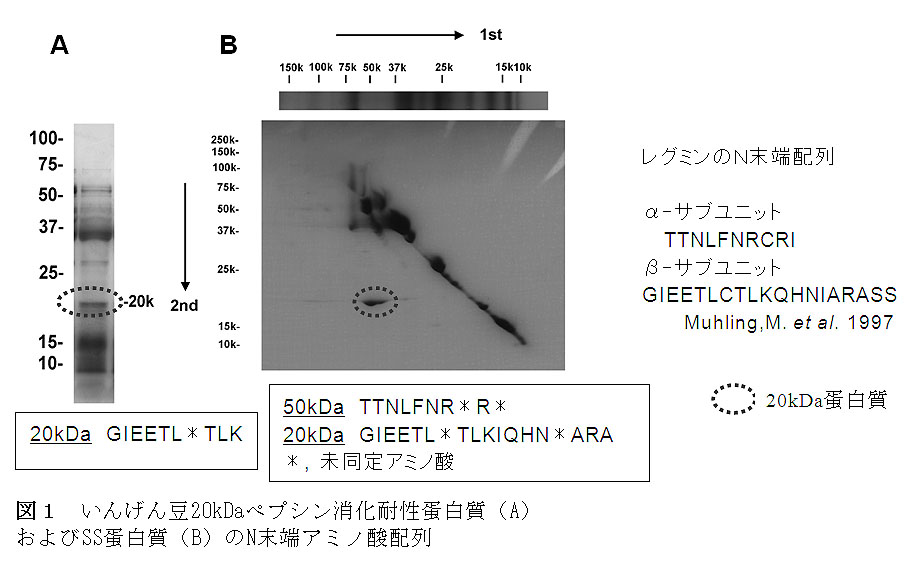
- いんげん豆(大正金時豆)を粉砕し、組み換え体食品等での未知アレルゲンの検出指標とされる、Astwoodらの方法 (Nature Biotech. 14, 1269-1273, 1996)を用いて、消化酵素ペプシンで15秒から60分間処理したときの消化性を調べた。加熱粗粉砕および微粒化処理の有無にかかわらず、豆粉では主要 蛋白質であるファゼオリンが顕著な消化耐性を示した。100℃、10分間のペースト化によって、ファゼオリンの消化性は著しく改善される一方、分子量 20kDaに高いペプシン消化耐性を示す蛋白質が見出された。
- 20kDa難消化性蛋白質のN末端アミノ酸配列解析を行ったところ、10残基の配列が解読され、貯蔵蛋白質レグミン(11S グロブリン)のβ-サブユニットの配列と一致した。また、対角線電気泳動上によって分離された、分子間SS架橋結合をもつポリペプチドについても同様にN 末端アミノ酸配列を解析した。その結果、分子量50kDa付近にレグミンα-サブユニット、20kDaにβ-サブユニットに一致するポリペプチドが検出さ れた。これらのことから、いんげん豆に微量に含まれる貯蔵タンパク質レグミンのβ-サブユニットが難消化性であることが明らかになった。(図1)。
- 蛍光試験法により、SS架橋結合の反応特性を調べ、いんげん豆20kDa難消化性蛋白質(レグミンβ-サブユニット)が、そばの主要アレルゲンであるレグミンと同様に、堅固な分子内SS結合で構造が保持されていることが示唆された。
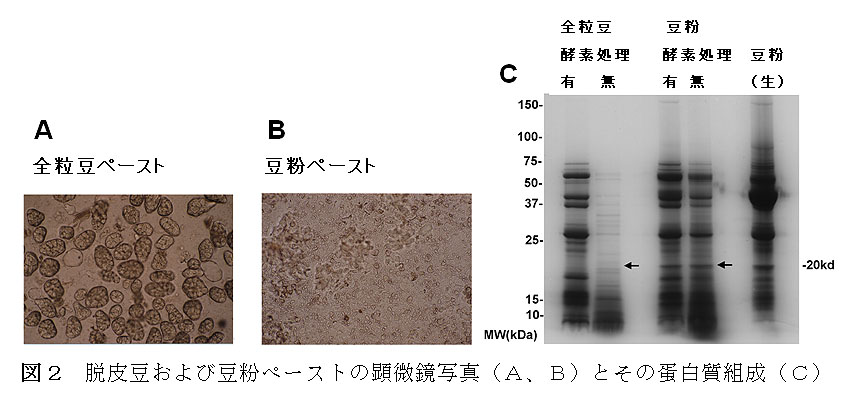
- 全粒豆および豆粉から調製した加熱ペーストの蛋白質組成を比較した。豆粉ペーストは蛋白質量は多いが、20kDa難消化性タンパク質が検 出された。一方、全粒豆ペーストでは、酵素処理の有無にかかわらず難消化性蛋白質のバンドは検出されなかった。全粒豆からの調製したペーストでは細胞由来 のあん粒子と呼ばれる構造が形成されることが顕鏡観察で確認され、粒子内部に難消化性蛋白質が包み込まれているものと推定された。
成果の活用面・留意点
- いんげん豆を粉砕加工することにより、あん粒子の形成を防ぎ、蛋白質利用効率が高まることが示された。
- いんげん豆には、微量ながら消化抵抗性蛋白質が検出され、レグミン(11Sグロブリン)サブユニットと同定された。今後、いんげん豆利用用途の開発にあたって、本タンパク質の挙動を制御していく必要がある。
具体的データ
その他
- 研究課題名:穀類および豆類種子蛋白質の構造および機能特性の解析
- 課題ID:312-e
- 予算区分:安信プロ
- 研究期間:2006~2010年度
- 研究担当者:門間美千子
- 発表論文等:
1)Momma(2006)Biosci. Biotech. Biochem. 70(12):3058-3061
2)Momma et al. (2007)Food Sci.Tech. Res. 13(2):166-168
3)Momma(2006)Proceedings 35th UJNR Food and Agriculture Panel:CE7-11
4)門間ら(2007)日本食品科学工学会第54回大会講演要旨集、p.105
5)Momma(2007)Proceedings 36th UJNR Food and Agriculture Panel:213-216
