NMRによるR型レクチンC末端ドメイン糖結合部位の結合活性測定
※アーカイブの成果情報は、発表されてから年数が経っており、情報が古くなっております。
同一分野の研究については、なるべく新しい情報を検索ください。
要約
通常のNMR滴定実験法及び今回改良を行ったNMR滴定実験法を用いることで、R型レクチンC末端ドメインの同一分子内に存在する2つの糖結合部位それぞれに対する糖結合活性を同時に測定することに成功した。
- キーワード:核磁気共鳴法、NMR、レクチン、糖、結合活性
- 担当:食総研・食品分析研究領域・状態分析ユニット
- 代表連絡先:電話029-838-8033
- 区分:食品試験研究
- 分類:研究・参考
背景・ねらい
R型レクチンファミリーと呼ばれる糖認識ドメインは、β-trefoilという共通の構造を持つにもかかわらず、そのリガント結合活性はさまざまであり、しかもその機能は多岐にわたることが知られている。その糖鎖認識メカニズムを解明することは、その機能を知る上で重要であるとともに、グライコプロテオミクスにおける糖鎖プロファイラーや糖鎖・糖タンパク質関連のバイオマーカーの開発等への基盤研究としても重要である。R型レクチンファミリーに属するタンデムリピート型タンパク質のレクチンは、一般に、単独ドメインでは赤血球凝集活性を持たないと考えられているが、ここで用いたR型レクチンC末端ドメイン(EW29Ch)は、単独ドメインでも赤血球凝集能を持つ。そこで本研究においては、R型レクチンファミリーの糖鎖認識メカニズム解明のために、EW29Ch中に存在する2つの糖結合部位それぞれの糖結合活性を核磁気共鳴(NMR)法により測定した。
成果の内容・特徴
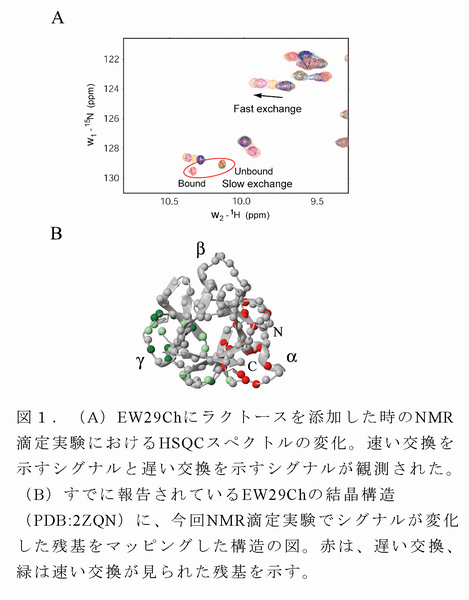
- NMR滴定実験法により、EW29Chは分子内に2つの糖結合部位(α糖結合部位とγ糖結合部位)を持ち、それぞれラクトースとの結合において異なる化学交換速度(α糖結合部位は遅い交換、γ結合部位は速い交換)を持つことがわかった(図1)。この糖結合部位は、最近報告されたEW29Ch‐ラクトース複合体のX線結晶構造で示された2つの糖結合部位と一致する。結晶構造では、糖との相互作用において2つの糖結合部位でほとんど差が見られなかったが、今回のNMR滴定実験では2つの糖結合部位において化学交換速度に大きな違いが認められた。
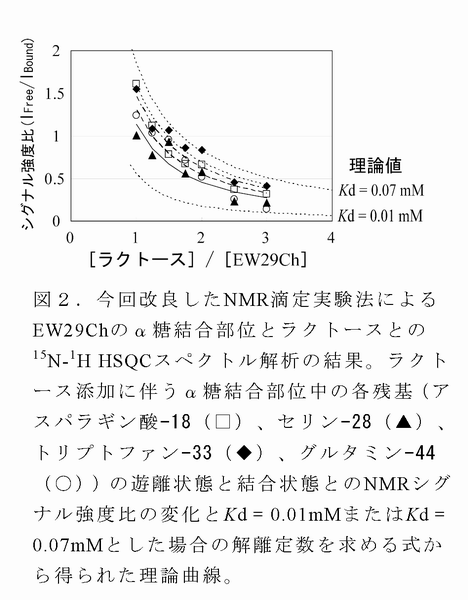
- 速い化学交換を示すγ糖結合部位の糖結合活性については、通常のNMR滴定実験法により解離定数(=1/結合定数)を求めた。一方、遅い化学交換を示すα糖結合部位については通常のNMR滴定実験法で糖結合活性を算出することは難しかった。そこで、タンパク質濃度を常法に比べ非常に低くして測定を行ったが、低濃度でのシグナル強度低下によって解離定数を求める式へのフィッティングが良くなかったことから、その式から得られる解離定数の理論曲線を用いることによりα糖結合部位の解離定数を算出した(図2)。その結果、2つの糖結合部位においてラクトースに対する糖結合活性が約100倍違うことがわかった(表1)。
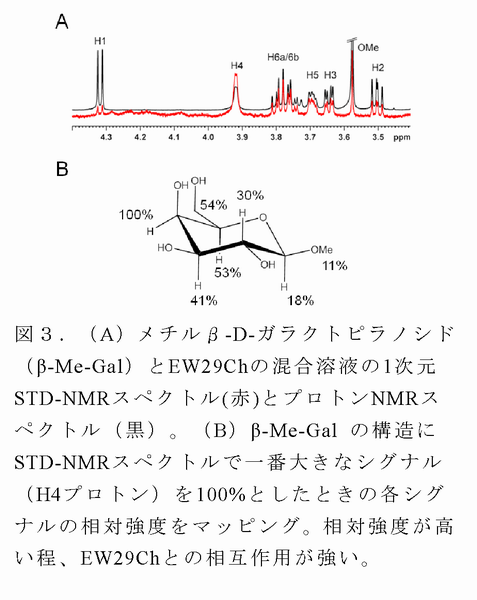
- 飽和移動差(STD)~NMR法により、EW29Chに対する糖の相互作用部位(エピトープ)を解析することができた(図3)。この結果は、上記の複合体X線結晶構造から得られた糖のエピトープとほぼ同じであった。
成果の活用面・留意点
- 通常のNMR滴定実験法に加えて、今回改良を行ったNMR滴定実験法により、同一分子内に存在する化学交換速度の異なる複数のリガント結合部位のそれぞれのリガント結合活性を同時に算出することができる。但し、強い結合活性(解離定数がnM以下の場合)を持つリガントに対しては適用できない。
具体的データ

その他
- 研究課題名:核磁気共鳴(NMR)法を用いての有用タンパク質の構造及び分子間相互作用解析による機能の解明
- 中課題整理番号:313f
- 予算区分:科研費
- 研究期間:2006~2009年度
- 研究担当者:逸見 光、久野 敦(産総研・糖鎖医工学研究センター)
- 発表論文等:H. Hemmi, A. Kuno, et al. (2009) FEBS J. 276 (7), 2095-2105
